✦
随着我国药品监管机制的日益成熟,国内制药企业的质量体系建设日趋健全,但质量管理成熟度与头部跨国制药企业相比仍有差距。本研究通过梳理美国食品药品管理局(FDA) 质量量度项目、质量管理成熟度项目的实施内容,调研跨国制药企业质量管理成熟度现状,比照剖析了我国制药企业在质量管理过程中药品质量管理成熟度的现状,总结了质量绩效指标策略、质量体系运行有效性、持续改进质量文化建设等三个方面存在的问题,并提出了通过转变药品生产监管理念、加强质量管理成熟度研究、借助数字化手段赋能我国制药企业质量管理成熟度提升的建议。
✦
2017 年,国家药品监督管理局成为国际人用药品注册技术协调会(ICH) 第八个监管机构成员单位,标志着我国药品监管工作进一步与国际接轨。ICH根据ISO 质量理念,为医药行业提供了一套有效的药品质量体系(ICH Q10) 模型,系统阐述了药品研发、生产全生命周期的质量管理模式,并广泛被跨国制药企业持续执行。调研显示,国内制药企业药品质量管理体系基于ICH Q10 的管理成熟度与头部跨国制药企业仍有差距,尤其是在持续有效的质量体系运行方面。本研究总结了美国食品药品管理局(FDA) 质量量度项目、质量管理成熟度项目的实施内容,以及跨国制药企业质量管理成熟度现状,初步探析我国企业质量体系的管理成熟度现状,期望能结合国际药品监管先进理念和跨国制药企业质量管理经验,借助数字化手段来指导企业认识和接受ICH Q10 内涵,赋能企业质量管理成熟度迈向更高阶段。
Part
1
国外制药企业质量管理成熟度现状
ICH Q10 鼓励企业在药品全生命周期质量体系中,能运用科学且基于风险的方法实现产品质量和体系管理的持续改进,即企业不仅要对工艺性能和产品质量进行持续改进,为确定的参数和属性提供可衡量和可分析的技术管理工具,确保受控状态的持续维持,也应当对质量体系进行持续改进,采用科学的质量绩效指标对质量体系过程进行有效监控,并定期开展质量体系有效性评估[1]。
1.1
美国FDA质量量度项目
美国FDA早在2013年就启动了制药企业质量量度计划(quality metrics program),期望通过对质量量度和质量文化的管理促进企业实现药品质量的卓越管理。美国FDA认为,企业通过对质量管理、质量文化的量化指标进行跟踪分析,可以改善整体质量体系水平。早期采用这种质量管理模式的企业,将系统科学的质量指标体系融合到企业良好的业务实践中,既实现了企业质量运营卓越的目标,同时也实现了药品质量的持续改进。FDA也一直在研究基于数据的质量体系性能指标,以期在发生质量事件之前预警质量风险: 一方面有助于制定科学的合规性检查策略,如可基于风险数据减少对高绩效企业的检查频率; 另一方面也有助于政府预测药物短缺的风险,引导企业实施先进的药品质量管理体系[2]。
2015—2016 年,美国FDA委托国际制药工程协会(ISPE) 开展了两期大规模质量量度研究,以确定表征药品质量体系有效性的指标。ISPE使用调查问卷收集了数十家原料药和制剂工厂数据,包括基于产品和基于工厂的指标,如投诉率、接受批次率、无效OOS 率、CAPA 有效性等。线性回归分析结果显示了大部分指标是密切相关性的,即表征质量文化的一些指标,最终也会反映到质量体系各方面性能指标和最终的产品质量指标[3,4]。美国FDA 质量量度计划指标相关性分析见图1。

图1 美国FDA 质量量度计划指标相关性分析
1.2
美国FDA质量管理成熟度项目
美国FDA在质量量度计划的基础之上,于2020年下半年启动了质量管理成熟度项目(quality management maturity,QMM) 。质量管理成熟度是为实现质量方针和目标,衡量已经建立的质量体系各业务流程的一致性、可靠性和稳健性水平,关注企业对业务流程和质量体系持续改进方面的表现。FDA认为,在符合cGMP的基础上形成基于ICH Q10的体系管理模式,于持续改进中达成质量运营卓越、质量文化卓越的状态,是质量管理成熟的必然路径[5]。美国FDA 基于ICH Q10的质量成熟度模型见图2。
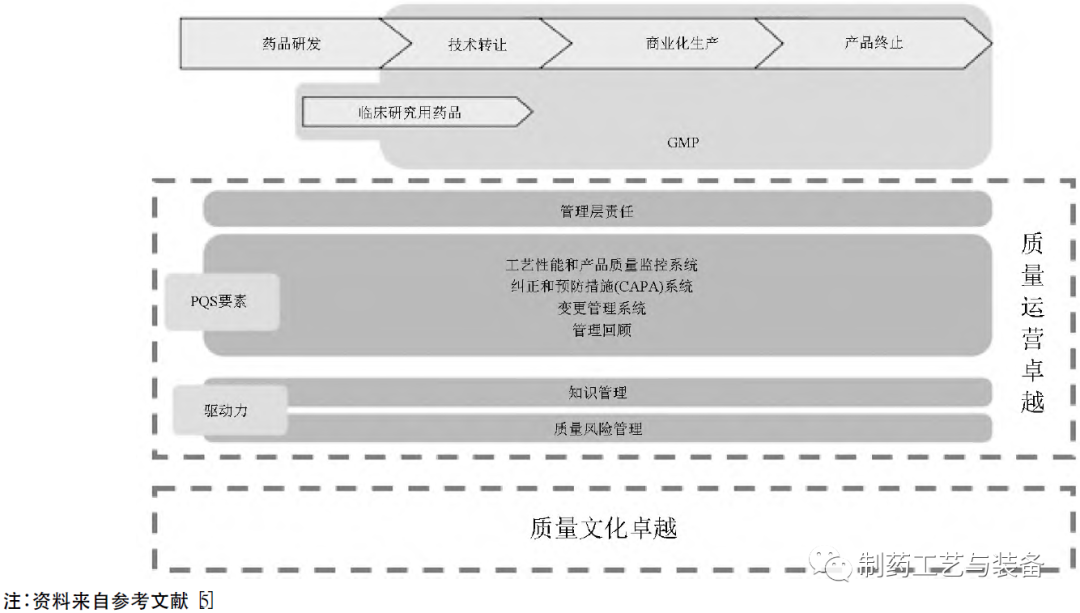
图2 美国FDA基于ICH Q10的质量成熟度模型
美国FDA药品质量管理成熟度项目不仅停留在药品全生命周期的质量体系纵向维度上,也在向药品生产企业管理的横向维度拓展,即引导企业打开管理思维,确实开展全面质量管理(total quality management,TQM),如生产运营、人力资源管理、安全生产、环境安全方面均纳入成熟度评估[6]。
1.3
跨国制药企业质量管理成熟度
2019 年, ISPE和美国注射剂协会(PDA) 发布了《制药企业质量文化提升指南》(以下简称《指南》) 。《指南》认为,质量文化不足的企业在调查质量事件根本原因时,常常以人为差错为根本原因,仅采取“再培训”的预防措施来结束调查。《指南》强调,“人为差错”不应作为根本原因调查的结论,而应作为新的调查起点。“再培训”的预防措施也不太可能获得长期稳定的改善效果,应该对差错背后的人为因素进行更深入的根本原因分析。ISPE 和PDA 的质量文化理念在跨国制药企业中得到了充分体现,《指南》提及的工具和方法,也被跨国制药企业广泛应用。以某跨国制药企业为例,对人为差错根本原因的分析,从差错事件的注意力因素、记忆力因素、学习因素、决策因素、资源因素和程序因素等方面进行多维度分析,直至找出根本问题所在,并制定有效的整改措施[7]。
本研究对多家跨国制药企业质量体系的有效性进行了调研,结果显示这些企业都具备较为成熟的质量体系管理机制。质量量度方面,具备科学的、完整的质量管理体系量化指标。企业会定期监测和分析质量体系运行的有效性、稳定性,异常趋势常常可以在问题发生前就为体系持续改善明确方向; 质量文化方面,企业将关键质量指标列入年度绩效考核,与其经济指标形成了良好的制衡关系。企业以质量为驱动、持续改善的文化也得到了充分体现。跨国制药企业质量与经济绩效指标体系示例见图3、图4。

图3 某跨国制药企业A 质量与经济绩效指标体系

图4 某跨国制药企业B 质量与经济绩效指标体系
Part
2
国内制药企业药品质量管理成熟度现状
本研究基于ICH Q10,将国内制药企业的质量管理成熟度分为5 个阶段(见图5) 。企业申办《药品生产许可证》时,需要具备基本的药品质量体系并接受监管部门的法规符合性检查,即第一阶段“初始的”; 商业化规模生产时,企业在《药品管理法》等强监管压力下主动强化主体责任以使其体系基本受控,即第二阶段“可控的”; 之后在经历GMP 检查员数次合规检查后,企业的质量体系建设日趋健全,即第三阶段“健全的”。
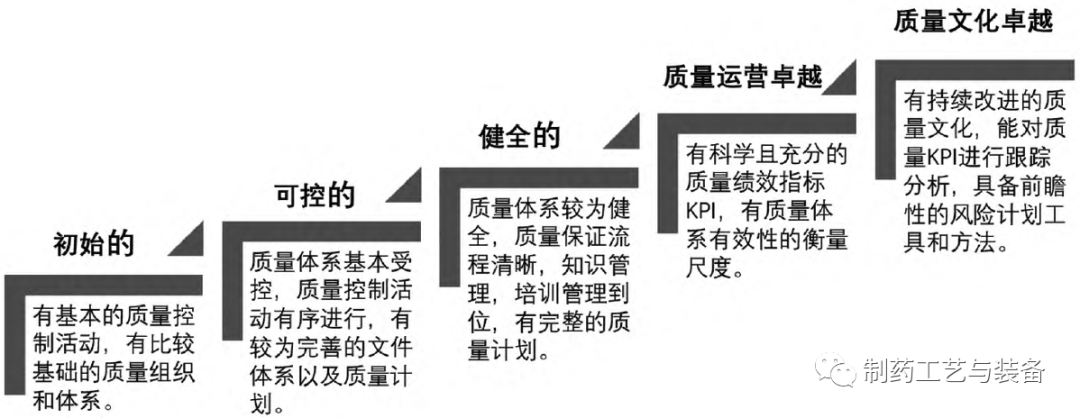
图5 基于ICH Q10 的药品质量管理成熟度分级
2019 年12月1日,新修订的《中华人民共和国药品管理法》(以下简称《药品管理法》) 生效。此后,国务院办公厅印发了《关于建立职业化专业化药品检查员队伍的意见》和《关于全面加强药品监管能力建设的实施意见》,国家药品监督管理局启动了国际药品检查合作计划(PIC/S) 的预加入申请程序[8-10]。一系列药品监管体制机制的改革和进步,促使国内制药企业的质量体系建设逐步走向健全,但距离实现质量运营卓越和质量文化卓越仍有差距。本研究对国内制药企业的质量管理成熟度现状做了调研分析,归纳出三个方面的问题。
2.1
企业绩效管理中质量指标不够充分
在国内制药企业绩效管理中,存在质量绩效指标的科学性、系统性不足,与经济绩效指标地位不对等情况,难以保证质量安全和生产效率的平衡。例如,国内制药企业使用的质量核心指标大多以“产品合格率”为主。产品合格率是最终合格产品数量占所生产产品的比例,即“良品率”或“收率”。一定程度上,该指标的内在属性是成本控制而非质量控制。跨国制药企业更多关注“一次合格率(right first time,RFT)”,即产品生产包装检验全过程无异常的产品数量占所生产产品的比例。RFT 更能体现药品的内在质量属性和“质量源于设计(QbD) ”的理念,表征了产品生产工艺和流程的稳定性。通过监测和分析影响RFT 指标的原因,更有助于识别体系中存在的系统性风险[11, 12]。
2.2
质量管理体系的运行有效性需要提升
国内制药企业质量体系运行的有效性仍然有较大提升空间,即“文件堆出来的质量体系”现象依然存在。一方面,国内制药企业保障质量管理体系有效运行的信息化系统支撑不足,诸如偏差管理、变更管理、CAPA 管理等业务仍处于线下纸质流程阶段,体系运行的一致性、及时性、有效性缺乏保障。另一方面,国内制药企业对质量绩效指标的持续监测分析和评价不足,绩效考核的触角无法有效传递到体系的各个运行环节。企业管理层无法及时、清晰、全面地看到本企业质量管理体系的实际运行情况,以致体系缺陷往往被忽视[13]。
2.3
持续改进的质量文化建设需要加强
比照ICH、ISPE 和PDA 的质量文化理念,国内制药企业以质量为驱动的企业文化氛围仍需加强。对质量事件,尤其是人为差错事件的根本原因分析深度和方法不足,导致基于根本原因的持续改善机会大大流失。国内制药企业在进行偏差调查时,往往最后粗浅地将根本原因落在人为差错上,仅将“再培训”作为预防整改措施以结束调查。在药品生产过程中,质量事件是发现问题、解决问题和持续改善的最好机会,但大多企业没有没有付出时间和精力或者不具备这个能力和意识深挖其根本原因,不能从根本上制定预防整改措施,谈不上具备持续改善的质量文化[7]。
Part
3
国内外制药企业质量管理成熟度对我国药品生产监管的启示
3.1
转变药品生产监管理念
《药品管理法》要求药品上市许可持有人须具备质量管理、风险防控和责任赔偿能力[14]。其中,质量管理能力是作为药品上市许可持有人的首要能力。不断提升质量管理能力和体系建设水平是药品上市许可持有人落实主体责任的最直接体现。国内已有头部企业效仿跨国制药公司的先进质量管理理念和实践经验,期望于持续改进中实现质量运营卓越、质量文化卓越的状态。药品监管部门也需要转变观念,药品监管工作不只是提升企业的法规符合性和技术成熟度,更要鼓励和指导企业在质量管理工具、方法上的创新应用,以实现制药企业最大程度地高效、敏捷、灵活地生产出质量可靠的药品[15]。
3.2
加强质量管理成熟度研究
结合国际药品监管先进理念和跨国制药企业质量管理经验,研究适用于我国制药企业质量管理的统一量度或指标定义、算法,指导企业依据自身质量能力选择适合的质量量度[12],在赋能企业高质量发展的同时,也具有赋能监管的直接价值。一方面帮助企业建立表征药品质量体系运行有效性的指标矩阵,实现自我管理和持续改进。另一方面,通过对企业质量管理运营和文化指标的监测分析对比,可以将事中事后监管渗透到企业日常的生产经营活动中,倒逼企业不断完善其质量管理体系,真正压实企业主体责任。
3.3
智慧监管加速质量管理成熟
统一的质量量度或指标最大程度地剥离了产品属性,通过信息化手段和算法模型评估企业药品质量管理水平,可实现药品质量监管从定性管理向基于数据的定量管理转变,也为企业和产品的横向比较提供了可能,如同一类剂型生产企业、不同企业生产的同一类产品、同一企业内不同产品、一段时间内企业的变化趋势等[16]。同时,以质量管理成熟度为基础的智慧监管平台,在采集、分析企业质量量度或指标数据的同时,也会倒逼企业加快偏差管理、变更管理、CAPA 管理等信息化系统建设[17]。
Part
4
结语
《关于全面加强药品监管能力建设的实施意见》提出要提升监管国际化水平,加快推进监管新工具、新标准、新方法研究和应用。目前,国内制药企业质量体系建设日趋健全,行业对质量管理进一步成熟的期望越来越强烈。因此,药品监管部门开展以质量量度为基础的质量管理成熟度研究,将为推动我国医药产业高质量发展发挥积极作用。
参考文献
[1] International Conference on Harmonisation. Guidance on Q10 Pharmaceutical Quality System [EB/OL]. (2009-04-08) [2022-8-17]. https: / /https: / /www. federalregister. gov /documents /2009 /04 /08 /E9-7875 /internationalconference-on-harmonisation-guidance-on-q10-pharmaceutical-qualitysystem-availability.
[2] FDA. Quality Metrics for Drug Manufacturing[EB/OL]. (2022-03-09)[2022-08-17]. https: / /www. fda. gov /drugs /pharmaceutical-quality-resources/quality-metrics-drug-manufacturing.
[3] ISPE. Quality metrics initiative: A report from the pilot project-wave1 [EB/OL]. (2015-06-01) [2022-08-17]. https: / /ispe. org /products /ispe-qualitymetrics-initiative-wave-1-report.
[4] ISPE. Quality metrics initiative: Quality metrics pilot program wave 2 [EB/OL]. (2016-06-01) [2022-08-17]. https: / /ispe. org /products /ispe-qualitymetrics-initiative-wave-2-report.
[5] ISPE. Quality Management Maturity Program: Advancing Pharmaceutical Quality[EB/OL]. (2020-10-08) [2022-08-17]. https: / /ispe. org /pharmaceutical-engineering /ispeak /ispe-quality-management-maturity-program-advancing-pharmaceutical.
[6] FDA. CDER Quality Management Maturity[EB/OL]. (2022-05-04) [2022-08-17]. https: / /www. fda. gov /drugs /pharmaceutical-quality-resources /cder-quality-management-maturity.
[7] ISPE – PDA Guide to Improving Quality Culture in Pharmaceutical Manufacturing Facilities[EB/OL]. (2019-10-07) [2022-08-17]. https: / /ispe.org /news /ispe-pda-create-guide-improving-quality-culture-pharmaceutical-industry.
[8] 国家药品监督管理局. 国务院办公厅印发《关于建立职业化专业化药品检查员队伍的意见》[EB/OL] . (2019-07-18) [2022-08-17]. https: / /www. nmpa. gov. cn /yaopin /ypjgdt /20190718174601792. html.
[9] 国家药品监督管理局. 国务院办公厅印发《关于全面加强药品监管能力建设的实施意见》[EB/OL] . (2021-05-10) [2022-08-17]. https: / /www.nmpa. gov. cn /zhuanti /ypjgssyj /ypjgssyjjj /20210510191205129. html.
[10] 国家药品监督管理局. 国家药品监督管理局启动药品检查合作计划(PIC/S) 预加入申请工作[EB/OL] . (2021-09-29) [2022-08-17]. https:/ /www. nmpa. gov. cn /yaopin /ypjgdt /20210929162552105. html.
[11] Steven Lynn,Susan Schniepp,Justin Anahory. Getting drug quality right thefirst time [EB/OL]. (2022-04-20) [2022-08-17]. https: / /www. pharmamanufacturing.com/articles /2022 /getting-drug-quality-right-the-first-time /.
[12] 王霞,陈恒青,朱建伟. 质量管理体系中实施质量量度对制药工业的意义[J]. 中国医药工业杂志, 2020,51(4) : 545-550.
[13] 包敏芝,胡延熹. 质量量度在国内药品生产企业中的应用[J]. 上海医药, 2016, 37(23) : 69-72.
[14] 国家药品监督管理局. 中华人民共和国药品管理法[EB/OL]. (2019-08-27) [2022-08-17]. https: / /www. nmpa. gov. cn /xxgk /fgwj /flxzhfg /20190827083801685. html.
[15] 张景辰. 加强事中监管,促进药品产业的供给侧改善—FDA 质量量度计划的启示[J]. 中国食品药品监管, 2016,(4): 56-58.
[16] 杨依晗,赵燕君,高惠君. 美国食品和药物管理局质量量度管理的简介及启示[J]. 中国新药与临床杂志, 2016, 35(4) : 260-263.
[17] 孙敏,谭德讲. 用合理的质量量度指标助力药品质量的科学监管[J]. 中国食品药品监管, 2021,(2) : 37-43.
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..