英国 MHRA 于 9 月 4 日发布了《药物警戒检查指标报告 2021年4月-2022年3月》,讨论了其良好药物警戒实践(GPvP)模式的变化如何影响其检查结果。
MHRA 在 2020 至 2021 财年推出了修订后的 GPvP 检查模型。该模型旨在促进选择适当的药物警戒系统、产品和非干预性研究进行检查。MHRA 在其 2021 至 2022 财年评估结果的报告中讨论了新模型对其检查结果的影响。
2021 年 4 月 1 日至 2022 年 3 月 31 日(2021/22)期间,MHRA GPvP 合规团队对 30 个上市许可持有人 (MAH) 进行了 32 次检查。
GPvP 检查模型由四个独立的检查部门组成,每个检查部门专注于特定的药物警戒活动:常规药物警戒活动、常规风险管理和安全沟通、额外风险最小化活动以及非干预性授权后安全研究 (NI-PASS)。使用基于风险的方法选择 MAH 进行检查,该方法与良好警戒实践 (GVP) 模块 III 中概述的原则一致,并考虑 GVP 模块 I 中概述的关键药物警戒流程。该方法确定被认为对患者安全风险最高的药物警戒系统、产品和非干预性研究,并有助于决定所需检查应属于哪个检查部门。这些例行检查包含在年度计划中,此外还包括因 GPvP 合规团队收到的先前关键发现或情报而触发的检查(“有因”检查)。报告第 3 节详细介绍了 2021/22 年四个检查部门各自的检查结果。
在 2021/22 年进行的 32 次检查中,有 5 次是为了评估之前检查中关键问题的解决情况而触发的,9 次是因收到情报而触发的,18 次是根据国家例行检查时间表安排和进行的。在这 18 次例行检查中,有 6 次检查是针对之前未经过 MHRA GPvP 合规团队检查(初次检查)的 MAH,而其余 12 次检查是对 MAH 的例行复查。
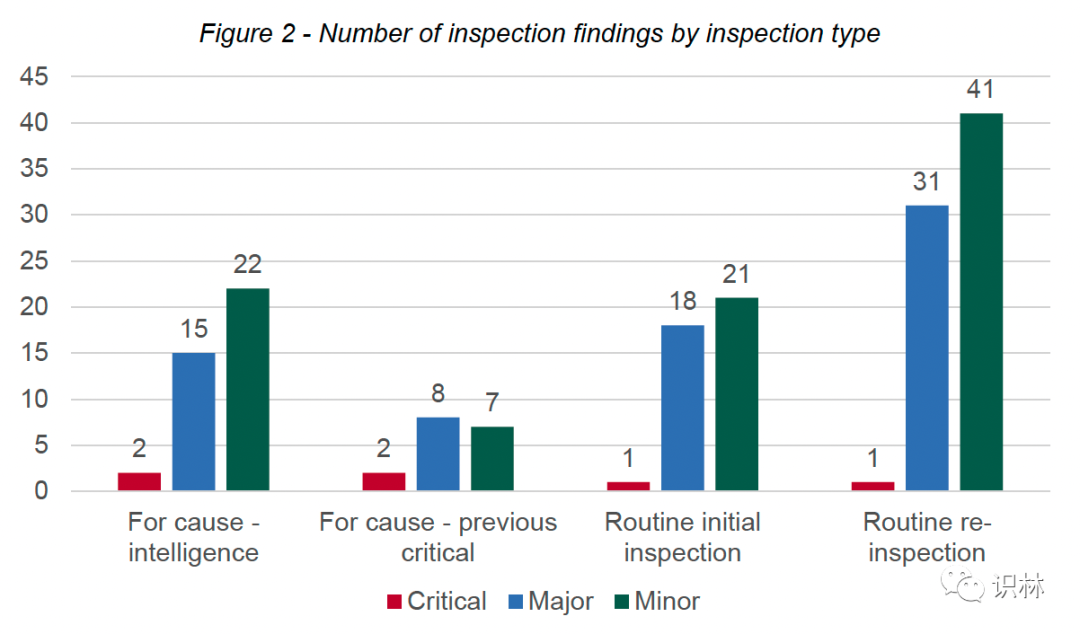
MHRA 在其报告中写道,“很明显,在审查指标时,风险管理是一个重要领域。四个检查部门中的三个主要关注风险管理领域。因此,在这个主题下报告了大量的发现。所有分级的结果分布在风险管理的每个子主题中,强调了在产品生命周期的所有阶段以及关键的药物警戒流程中管理患者风险的重要性。”
MHRA 计划继续在四个检查部门的检查安排中采用基于风险的方法,根据产品风险状况、药物警戒系统的复杂性以及从外部和内部来源收到的情报确定检查的优先顺序。该团队将使用混合模型,并根据一系列因素决定是否进行现场检查或远程检查。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..