根据PDUFA的预期目标日期,预计9月,美国FDA将对6款创新药物或疫苗的批准做出监管决定,本文将对这些疗法或疫苗进行相关介绍。
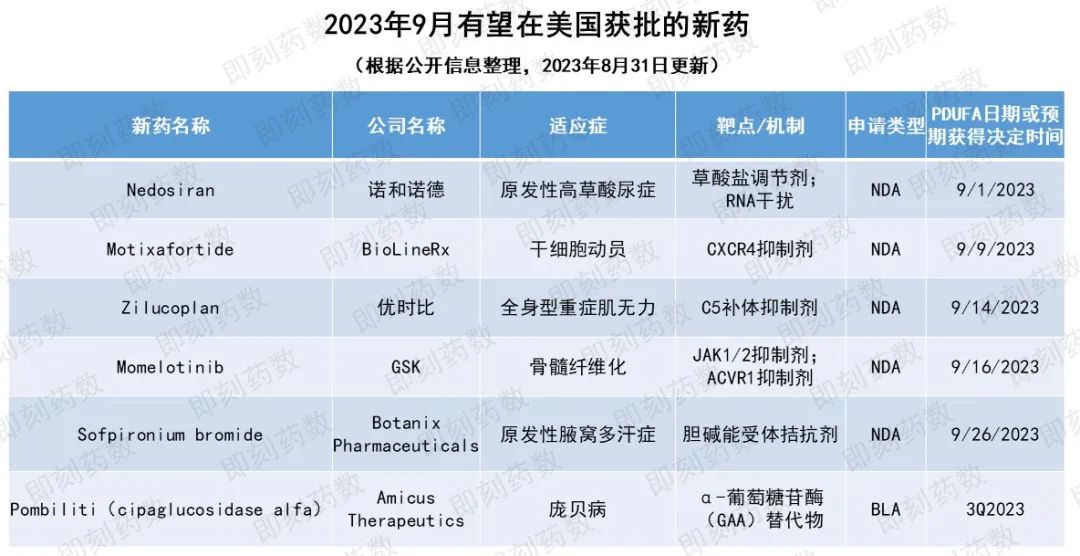
▲9月有望在美国获批的新药
药物名称:Nedosiran
适应症:原发性高草酸尿症(PH)
公司名称:诺和诺德(Nova Nordisk)旗下Dicerna Pharmaceuticals
原发性高草酸尿症(PH)是一种超罕见、危及生命的遗传病,根据基因突变分为三种已知亚型PH1、PH2和PH3。这些基因突变引起的代谢酶缺乏,导致草酸盐的过度产生。草酸盐的过量积累会引起复发性肾结石、肾钙质沉着症和慢性肾病,可能进展为需要透析的终末期肾病。
Nedosiran是一款RNAi疗法,通过与表达肝乳酸脱氢酶(LDH)的mRNA结合,抑制该蛋白表达,这是导致草酸盐过度生成的关键代谢酶。
在一项2期临床试验中,nedosiran达到主要终点,在PH1亚型患者中,与安慰剂相比,nedosiran组患者的尿液中草酸盐排泄较基线显示出统计学显著性的降低(p<0.0001)。试验也达到其关键次要终点,与安慰剂相比,在第90天后的两次或两次以上连续随访时,nedosiran组患者达到并维持正常、或接近正常草酸盐排泄(Uox)的比例显著更高(50%比0%,p=0.0025)。在接受nedosiran治疗的患者中,73%在试验期间至少发生1次达到正常化或接近正常化。
药物名称:Motixafortide
适应症:用于多发性骨髓瘤(MM)患者自体移植的干细胞动员(SCM)
公司名称:BioLineRx
多发性骨髓瘤是第二常见的血液系统恶性肿瘤,自体干细胞移植是标准治疗模式的一部分,可延长该癌症患者的生存期。尽管有可用的治疗方法,许多患者仍然无法收集充足数量的血液干细胞进行移植。
Motixafortide是一款创新CXCR4抑制剂。GENESIS临床3期试验的关键结果显示,该药物达到所有主要和次要终点,支持在G-CSF的基础上加用motixafortide,以作为多发性骨髓瘤患者在移植时促进SCM的潜在新标准治疗。在试验中,在G-CSF的基础上加用motixafortide使大多数患者能够在单次给药中实现采集≥600万个造血干细胞的目标。该药物与G-CSF组合通常显示良好的耐受性以及安全性特征。
药物名称:Zilucoplan
适应症:全身性重症肌无力(gMG)
公司名称:优时比(UCB)
gMG是一种罕见的慢性自身免疫性疾病。患者自身的致病性免疫球蛋白G(IgG)抗体会破坏神经和肌肉之间的突触传递,引起虚弱和可能危及生命的肌无力。
Zilucoplan以高亲和力和特异性、靶向与末端补体激活途径的组分C5结合,这可防止C5被C5转化酶裂解为补体成分C5a和C5b,进而阻止膜攻击复合物(MAC)的下游组装和活性。此外,zilucoplan与对应于C5b的C5结构域结合,从而阻断C5b与补体成分C6的结合。Zilucoplan通过抑制末端补体途径激活和MAC下游组装的双重作用机制,防止其破坏离子通道传导和神经肌肉信号传递。
关键性3期RAISE试验共入组174例患者,以1:1的比例随机接受zilucoplan或安慰剂每日皮下给药,治疗持续12周。试验达到其主要终点,使用zilucoplan治疗可在关键的gMG特异性的结果方面产生具有临床意义和统计学意义的改善——在第12周时,zilucoplan组患者的安慰剂矫正的重症肌无力-日常生活活动能力量表(MG-ADL)总分平均改善了2.09分(p<0.001)。此外,zilucoplan的安全性和耐受性良好,两组治疗后出现的治疗伴发不良反应发生率相似——zilucoplan为76.7%,安慰剂为70.5%。
药物名称:Momelotinib
适应症:骨髓纤维化
公司名称:GSK
Momelotinib具有独特的作用机制,可抑制三条关键信号通路:激活素A受体I型(ACVR1)、JAK1和JAK2。骨髓纤维化是一种由JAK-STAT信号异常导致的罕见血液肿瘤,其症状特征包括脾脏肿大、进行性贫血和其它全身性症状。
在治疗骨髓纤维化患者的一项关键性3期临床试验中,momelotinib达到所有主要和关键次要终点。治疗24周时,momelotinib组达到总体症状评分(TSS)较基线改善超过50%的患者比例为25%,对照组这一数值为9%。24周时不依赖输血的患者比例:momelotinib组为31%,对照组为20%;脾脏体积减少超过35%的患者比例:momelotinib组为23%,对照组为3%。这表明momelotinib在缓解症状、脾脏应答和控制贫血方面较对照组具有统计学显著性的改善,且这一改善具有临床价值。
Sierra Oncology于去年6月向美国FDA递交momelotinib治疗骨髓纤维化的新药申请(NDA)。在去年7月,GSK宣布完成对Sierra Oncology公司的收购。获得这款在研疗法的开发权益。
药物名称:Sofpironium bromide
适应症:原发性腋窝多汗症
公司名称:Botanix Pharmaceuticals
Sofpironium bromide是一种抗胆碱能/抗毒蕈碱药物,通过与受体结合阻断出汗信号,从而抑制腺体出汗。该疗法设计为使用专有涂抹器将Sofpironium bromide以凝胶制剂的形式递送至腋下,使患者避免直接接触手上的药物。在3期试验当中,约85%患者在使用15% Sofpironium Bromide凝胶后病情出现具临床意义的改善。
在2021年末所公布的两项Sofpironium bromide临床3期试验的积极结果显示,该药物达成所有主要和次要终点。这两项3期研究共超过700例患者入组,并有约300例患者参加一项为期48周的药物安全性研究。在所有研究中均未发生治疗相关严重不良事件,不良事件为一过性,性质为轻度至中度。
药物名称:Pombiliti(cipaglucosidase alfa)
适应症:庞贝病
公司名称:Amicus Therapeutics
庞贝病是一种由酸性α-葡萄糖苷酶(GAA)缺乏所引起的遗传性溶酶体贮积症。GAA水平的降低或缺失导致糖原在肌肉及其他组织的溶酶体中堆积,继而引发了庞贝病相关的病症(如肌无力和呼吸功能不全),甚至造成患者死亡。
Pombiliti是一种独特的人源重组酸性α-葡萄糖苷酶,其化学结构经过优化后可加强细胞对药物的吸收。今年3月,欧盟委员会批准Pombiliti上市,作为长效酶替代(ERT)疗法,与miglustat联用,治疗晚发型庞贝病成人患者。Miglustat是一种口服酶稳定剂,旨在增强Pombiliti的活性。今年8月,英国监管机构亦批准该疗法上市。
Pombiliti的批准是基于关键性3期临床试验PROPEL的临床数据,试验结果显示,与标准治疗方式alglucosidase alfa相比,这一组合在治疗晚发型庞贝病患者(包括已经接受过酶替代疗法但治疗需求尚未得到满足的患者)方面获得了具有临床意义的改善效果。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..