根据对 2022 年批准证据的最新分析,FDA 正在持续降低新药申请的批准标准。根据 8 月 8 日发表在《美国药学会杂志》(JAMA)的一封题为“支持 2022 年美国 FDA 药品批准的证据审查”的研究信,FDA 在过去几年中持续使用不太严格的新药批准标准。
研究者评估了支持 FDA 在 2022 年批准的 37 种新药的证据。他们发现,在用于评价 37 件药品申请的 415 项研究中,只有 55%(227 项研究) 是随机临床试验。大多数研究(79%)由行业申办,不到 1% 由美国国立卫生研究院(NIH)申办。
此外,FDA 2022 年的批准中有 65% 是单一研究支持的,而 2016 年,仅有 20% (20 个新药批准的 4 个)的新药批准是由单一研究支持的。另外,整个 37 种新药中,只有 4 种药物(11%)是基于 3 项或更多研究批准的,这四种药分别是:阿布昔替尼((abrocitinib)、奥特康唑( oteseconazol)、超极化氙 Xe 129,以及替西帕肽(tirzepatide)。而 2016 年,有 55% 的产品基于 3 项或以上研究获得批准。
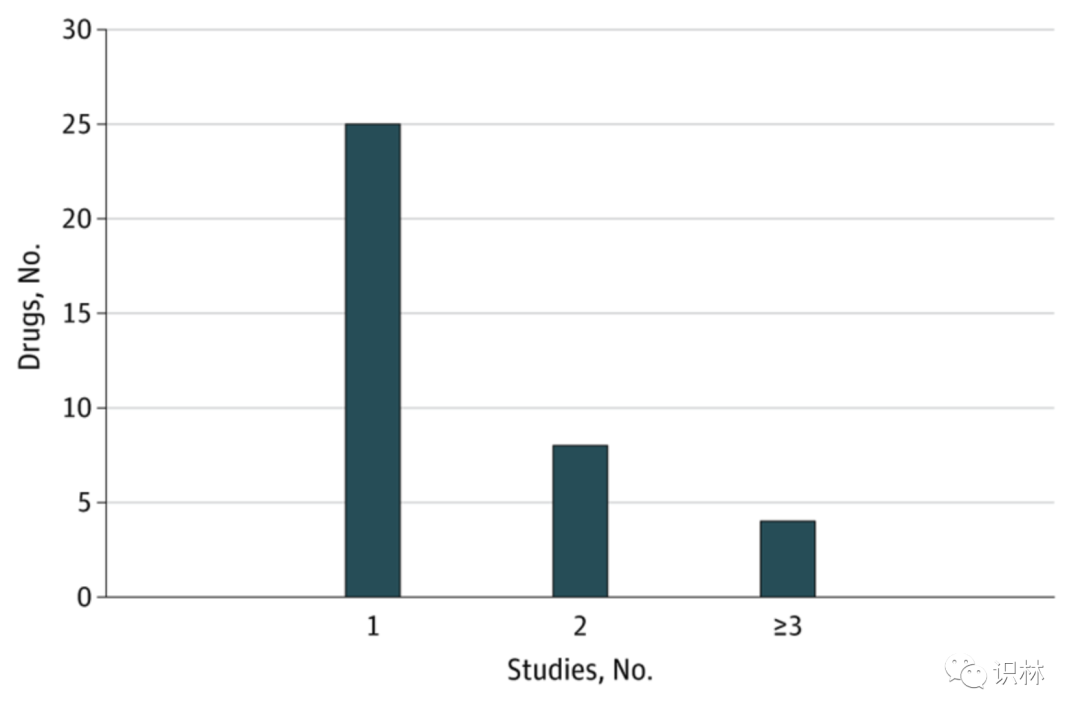
2022 年美国 FDA 基于 1、2、3 项或更多研究批准的产品数量
在可供分析的 413 项研究中,165 项 (40%) 平均在批准前 8.4 (60.6) 个月完成。103 项研究 (25%) 的结果已发布,其中 24 项研究 (6%) 的结果在批准后 6 个月内首次发布。
作者指出,与 2016 年《21 世纪医药法案》通过之前相比,新药批准所需的研究似乎更少了。法案赋予 FDA 在新药审批中应用基于证据的标准的更大灵活性。文章中指出,“我们相信消费者应该获得他们正在考虑的药物的全部证据,而不仅仅是来自向公众发布的特定研究。”
[1] Kaplan RM, Koong AJ, Irvin V. Review of Evidence Supporting 2022 US Food and Drug Administration Drug Approvals. JAMA Netw Open. 2023;6(8):e2327650. doi:10.1001/jamanetworkopen.2023.27650
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..