一家成立近四年的中国Biotech企业被全球超级药企辉瑞起诉超一年后,事态方向有了新的转变。
被控告窃取GLP-1产品开发信息
日前,辉瑞与中国药企锐格医药向美国康涅狄格州联邦法院宣称,他们正在签署一项协议,以试图结束双方此前的侵权诉讼。
援引医药魔方Invest的报道称,在美国法院发布的一项联合动议中,原告辉瑞和被告锐格医药创始团队成员邱夏杨、钟敏表示,双方已就和解达成原则协议,将继续真诚地努力敲定和解协议。与此同时,他们也希望法院可以给予更多的时间。根据联合动议的内容,双方将最后的期限定在2023年7月5日。

锐格医药与辉瑞签署的联合动议
在此之前,辉瑞和锐格医药有告知法院和解谈判的状况以及本诉讼的任何进一步程序的必要性,而如果双方同意自2023年7月5日起需要进一步的诉讼,则应于该日期当天向管理该诉讼的法院提交一份修改后的时间表。这也意味着该起于去年2月的诉讼之争有了较与之前完全不同的走向。
去年2月,辉瑞向美国康涅狄格州联邦法院起诉了其两名前雇员邱夏杨和钟敏,指控两人在辉瑞任职期间,窃取辉瑞在研的治疗糖尿病和肥胖症药物相关的商业机密,且在美国马萨诸塞州创建了Regor Therapeutics以及位于中国上海的QILU Regor Therapeutics(上海齐鲁锐格医药研发有限公司,简称锐格医药),推出了与辉瑞“惊人相似”的药物。
据了解,邱夏杨曾在辉瑞担任执行董事,并在29项临床候选药物中的研发中做出贡献,钟敏曾任辉瑞药代动力学、代谢总监及其外部研究解决方案的负责人,两人均在辉瑞工作超十年。
在此前的诉讼里,辉瑞认为邱夏杨和钟敏在还未从公司离职时,利用职务之便窃取了辉瑞胰高血糖素样肽-1受体(GLP-1)产品计划的关键开发和规划信息,而这些产品信息也成为了锐格医药快速推出自有GLP-1产品的基础。
彼时,对于辉瑞的指控,锐格医药方面表示该诉讼完全没有根据,公司会继续推动现有药物的研发。
同类型药物正在美开展二期临床试验
公开资料显示,锐格医药创立于2018年7月,聚焦瘤、免疫和代谢疾病等三大治疗领域,致力于开发这三大疾病领域具有自主知识产权的创新药(first-in-class)和最佳同类药(best-in-class),在官网信息中,锐格医药称其建立了核心技术平台rCARD™,该平台融合了结构生物学、生物信息学、计算化学等多学科,以人工智能算法加速新药的研发。
由于主打创新药的研发,锐格医药自成立以来就获得了资本的青睐,2018年,获得齐鲁制药A轮投资,2021年2月,又完成9000万美金B轮融资,由礼来亚洲基金领投,正心谷资本、澜亭资本、泰福资本和祥峰投资共同参与。
在产品开发方面,目前,锐格医药研发管线已囊括了多款产品,其中,CDK2/4/6抑制剂RGT-419B目前正在美国开展1期临床。可用于治疗肥胖、II型糖尿病、非酒精性脂肪肝等适应症的口服小分子GLP-1受体激动剂RGT-075也正在美国开展II期临床,与辉瑞和礼来并列全球第一研发梯队,是锐格医药旗下进展最快的产品。
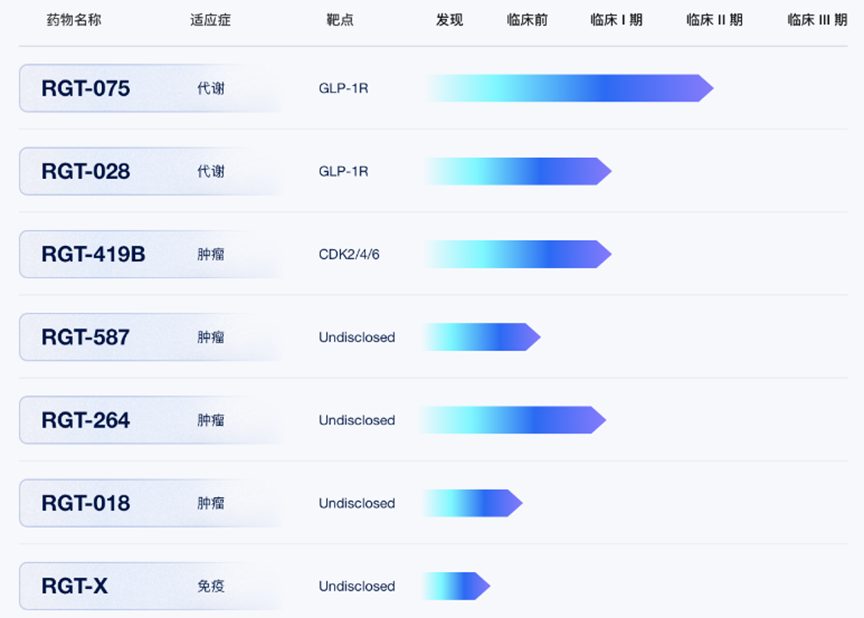
锐格医药的在研管线
2021年12月,锐格医药与礼来达成合作,双方将在未来数年内共同开发针对代谢性疾病领域的创新疗法,重点项目就包括RGT-075,通过该合作,锐格医药获得总计5000万美元的预付款,其中包括部分股权投资,此外还将获得最高15亿美元的潜在临床前、临床开发和商业化里程碑付款,以及个位数至较低两位数的全球销售分成,这对于一家成立短短几年的Biotech,如此大体量的交易规模并不多见。
值得关注的是,RGT-075也正是此前辉瑞发起控诉的焦点,辉瑞有一款同类药物,代号为PF-06882961(Danuglipron),其同样是一款口服小分子GLP-1受体激动剂,今年5月,辉瑞公布了Danuglipron 2b期临床试验结果。试验结果显示,在2型糖尿病患者中,Danuglipron显著降低患者的糖化血红蛋白(HbA1c)、空腹血糖水平和体重。接受最高剂量Danuglipron治疗患者的HbA1c降低1.16个百分点,体重减少4.17公斤。
就在近日,由于在临床试验中出现了转氨酶升高等问题,辉瑞宣布停止了Danuglipron的“姐妹产品”Lotiglipron的开发,Danuglipron由此则成为了辉瑞接下来重点推进的产品之一,目前Danuglipron的中期试验已完成全部参与者入组,预期到2023年底能够完成最终试验阶段的计划,后续将在此基础上开发每日一次的给药版本。根据辉瑞此前披露的开发计划,Danuglipron适用于糖尿病和肥胖症的治疗均计划于2025年申报上市,2026年获批上市。
角逐之战
近年来,GLP-1受体靶点正在成为减重药研发的主流方向,相较于使用繁复的注射剂型,GLP-1口服剂型产品由于使用起来更为便捷,能够提高患者的依从性,从而实现更好的减肥效果,因此,各大药企均在开足马力争夺口服GLP-1受体激动剂市场地位,以此抢得先机。
除了辉瑞的Danuglipron和锐格医药的RGT-075,司美格鲁肽无疑是GLP-1口服类产品的“当红炸子鸡“,其针对减重的IIIa期OASIS 1研究数据。结果显示,68周后,口服司美格鲁肽50mg组患者的体重减轻了17.4%(18.34kg),安慰剂组患者的体重则减轻1.8%(1.9kg);此外,口服司美格鲁肽50mg组中,有89.2%的患者在68周后减重≥5%(5.27kg),而安慰剂组仅有24.5%的患者减重超过5%。
诺和诺德预计将于2023年在美国和欧盟申请司美格鲁肽50mg片剂的监管批准。与此同时,口服司美格鲁肽日前也在中国首次启动了针对减重的三期临床试验,将在北京大学人民医院、复旦大学附属华山医院等15家医院开展。
此外,礼来的口服GLP-1R激动剂Orforglipron也已完成2期临床试验,第26周的主要终点评估中,orforglipron组(12mg, 24mg, 36mg或45mg)在所有剂量下均显示出具有统计学意义的剂量依赖性体重减轻,减重范围为8.6%(19.8磅或9.0公斤)至12.6%(29.3磅或13.3公斤),在第36周时,所有剂量的体重都有所减少,范围为9.4%(21.6磅或9.8公斤)至14.7%(34.0磅或15.4公斤)。
国内也有部分药企在布局GLP-1口服类产品,包括恒瑞医药的SHR-2042、信立泰的SAL0112,其中,SHR-2042于近日获批临床试验,主要用于治疗二型糖尿病和肥胖症患者,SAL0112于去年8月获批开展成人肥胖患者或超重患者的体重管理适应症Ⅰ期临床试验。
关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..