6 月 28 日,君实生物宣布,抗 BTLA 单抗 JS004(TAB004,tifcemalimab)联合特瑞普利单抗作为局限期小细胞肺癌(LS-SCLC)放化疗后未进展患者的巩固治疗的随机、双盲、安慰剂对照、国际多中心 III 期临床研究获 FDA 批准,预计于近期正式启动临床。
Tifcemalimab 由君实自主研发,是全球首个进入临床开发阶段的抗 BTLA 单抗;JS004-008-III-SCLC 研究也是抗 BTLA 单抗药物首个确证性研究,将由山东第一医科大学附属肿瘤医院院长于金明院士担任主要研究者,计划在中国、美国、欧洲等地入组 756 例患者。

截图来自:企业公告
君实认为,Tifcemalimab 与特瑞普利单抗联合用药是一种极具前景的抗癌治疗策略,有望增加患者对免疫治疗的反应,扩大可能受益人群的范围。当前,已有多项联合用药 Ib/II 期临床研究正在中国和美国同步开展中,覆盖多个瘤种。
在本月初的 2023 ASCO 年会上,君实以壁报形式(摘要编号:#8579)首次展示了 tifcemalimab 用于广泛期小细胞肺癌的一项 I/II 期临床研究初步数据。
这项开放标签、两队列、多中心的 I/II 期临床研究(NCT05000684)由吉林省肿瘤医院程颖教授和中国医学科学院肿瘤医院王洁教授牵头开展,旨在晚期肺癌(NSCLC 和 ES-SCLC)患者中评估 tifcemalimab 联合特瑞普利单抗治疗的安全性和抗肿瘤活性。
截至 2023 年 3 月 14 日,共纳入 43 例既往治疗失败的难治性 ES-SCLC 患者,中位年龄为 58.6(范围:38~75)岁。其中,15 例(34.9%)患者既往接受过免疫治疗,19 例(44.2%)患者既往接受过至少 2 线系统性治疗。至数据截至日,中位随访时间为 26.4 周。
截至 2023 年 3 月 14 日(中位随访 26.4 周),研究结果显示,对于难治性 ES-SCLC 患者,尤其是 I-O 初治患者,tifcemalimab 联合特瑞普利单抗治疗显示出良好的抗肿瘤活性,且耐受性良好。
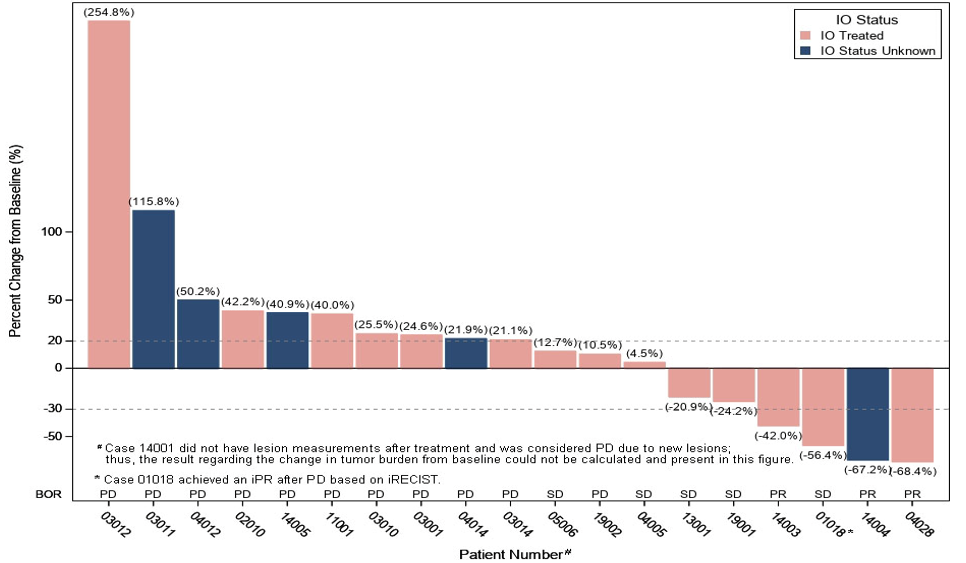
在 40 例疗效可评估患者中,研究者评估的客观缓解率(ORR)为 27.5%(95%CI: 5.3-27.9),疾病控制率(DCR)为 55.0%(95%CI: 31.2-62.3)。
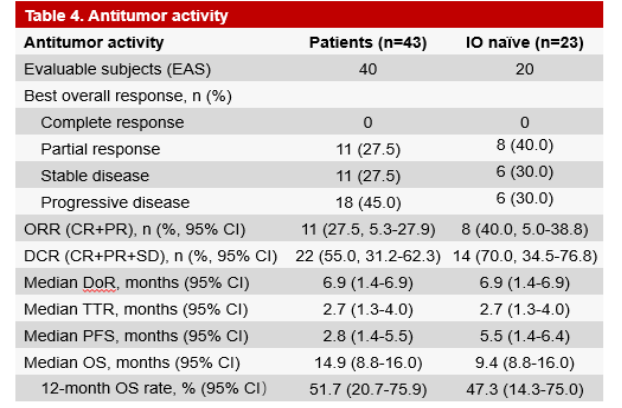
其中,对于 20 例疗效可评估的 I-O 初治患者,tifcemalimab 联合特瑞普利单抗治疗的 ORR 为 40.0%(95%CI: 19.1-63.9),DCR 为 70.0%(95%CI: 45.7-88.1);中位缓解持续时间(DoR)为 6.9 个月(95%CI:1.4-6.9),其中 3 例(15.0%)患者的 DoR 超过 6 个月;中位 PFS 为 5.5 个月(95%CI:1.4-6.4)。
20 例 I-O 初治患者的最大肿瘤消退率
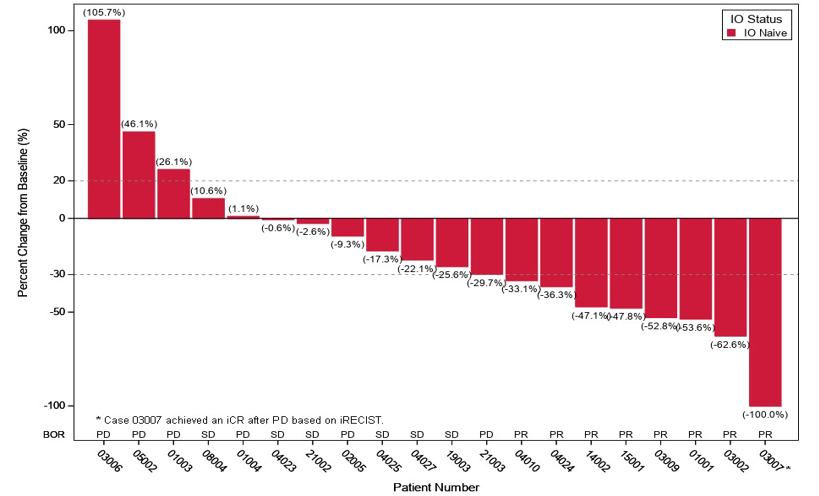
20 例疗效可评估的非 I-O 初治患者中包括了 15 例 I-O 经治和 5 例既往 I-O 治疗情况不详患者,分别有 2 例 1 例患者的最佳总体疗效达到部分缓解(PR)。
20 例非 I-O 初治患者的最大肿瘤消退率
根据 GLOBOCAN 2020 发布的数据显示,肺癌是目前我国发病率和死亡率均排名首位的恶性肿瘤,其中小细胞肺癌占到 15% - 20%,是侵袭性最强的亚型,局限期小细胞肺癌(LS-SCLC)约占三分之一。
对于无法手术或拒绝手术的 LS-SCLC 患者,同步放化疗(CRT)为标准治疗(SOC),但预后仍较差,中位无进展生存期(mPFS)约为 13.5 个月,中位总生存期(mOS)在 16-24 个月,5 年生存率仅 15% - 26%。因此,LS-SCLC 的治疗仍然存在巨大的未满足治疗需求,临床亟需探索疗效更优、耐受性良好的方案,进一步延缓 LS-SCLC 患者的疾病进展,延长总生存期,提高 5 年生存率。
当前,全球尚无免疫检查点抑制剂获批用于 LS-SCLC。
Insight 数据库显示,除君实之外,全球另有 4 款靶点为 BTLA 的新药进入临床开发阶段,不过除了 HiFiBiO Therapeutics 的 HFB200603 之外,其他 3 款都属于激动剂,用于治疗自身免疫疾病。
题图来源:企业 Logo
内容来源:君实生物公告,君实医学公众号,Insight 数据库
四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..