2023年,新药上市喜讯不断!仅上半年美国FDA已批准23款新分子实体,此外还批准了多款细胞与基因疗法。
据统计,截至6月25日,2023年美国药品审评中心(CDER)总计批准54项NDA申请和8项BLA申请,其中23款为新分子实体。
另外,美国生物制品中心(CBER)还批准了10款生物制品,包括2款基因疗法、1款细胞疗法、1款微生物疗法和1款重组蛋白药物。
详细情况见下文。
01
23款新分子实体获批上市
2023上半年,CDER批准23个新分子实体,包括17款化药和6款生物药。
化药
表1 CDER批准的化药新药
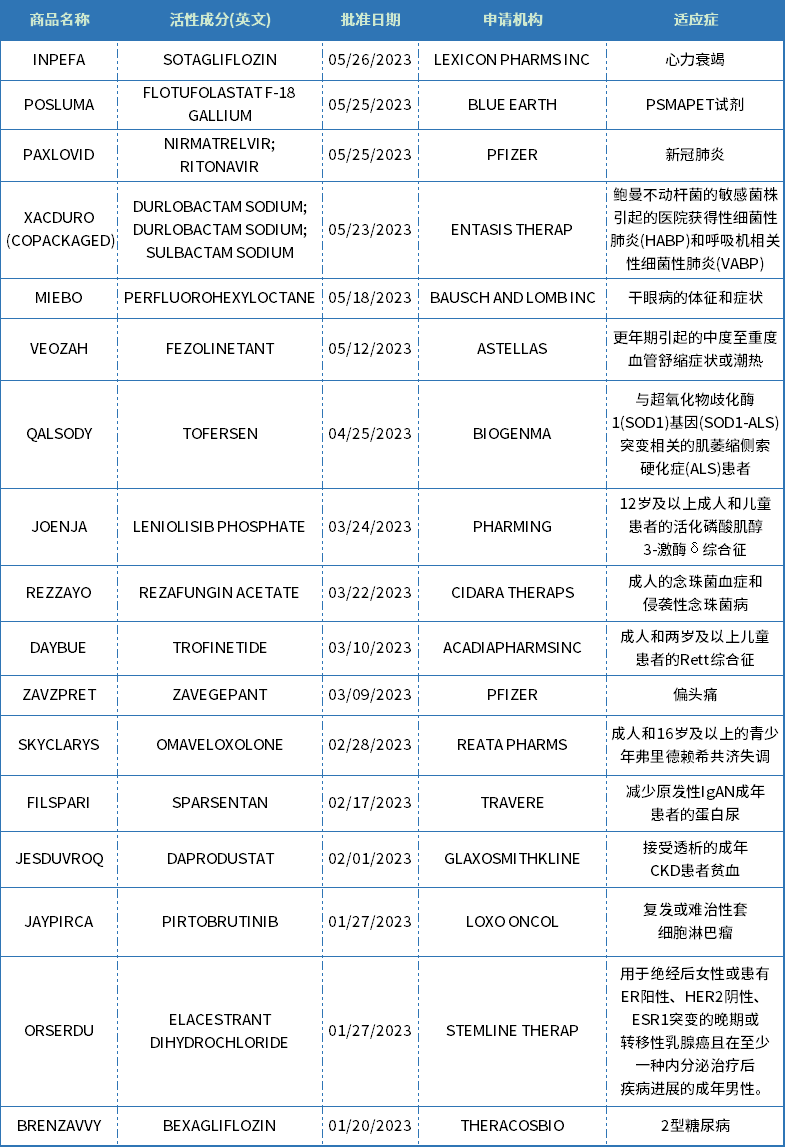
资料来源:美国FDA官网、药智数据
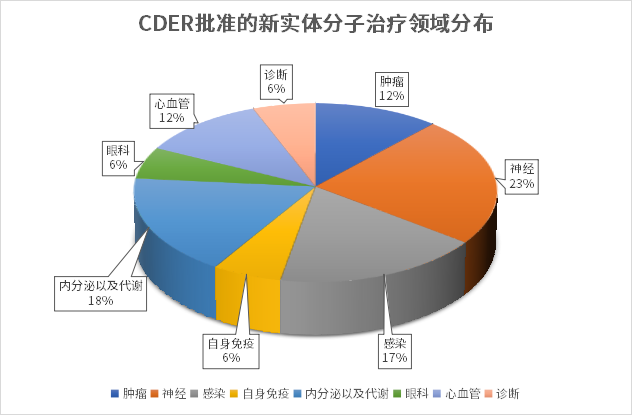
从治疗领域来看,神经科学、内分泌与代谢、抗感染、肿瘤、心血管等疾病领域都有多款新药获批上市。2023上半年,FDA批准的小分子药物中神经治疗领域占比最多,有4款,细分来看有3款是罕见病方向。此外,内分泌与代谢领域也是今年的热点,有BRENZAVVY、JESDUVROQ、FILSPARI三款新药获批。而在肿瘤领域,近些年随着IO疗法、ADC、以及CAR-T等新疗法的蓬勃发展,生物药逐渐成为肿瘤治疗的主要研发方向,2023年上半年FDA批准的肿瘤治疗领域小分子药物仅有两款,实体瘤和血液瘤各一款,而在获批的生物药新药中肿瘤药占比接近一半。
资料来源:美国FDA官网、药智数据
从审批方式来看,11款药物通过优先审评方式获批上市,7款新药曾获得孤儿药认证。
从申报企业来看,辉瑞成为新药获批的最大赢家,2023年上半年收获2款化药新药,包括用于治疗新冠病毒感染的PAXLOVID和偏头痛治疗药物ZAVZPRET。此外,辉瑞的RSV疫苗ABRYSVO也在今年上半年获得CBER批准获上市。
生物药
表2 CDER批准的生物药新药
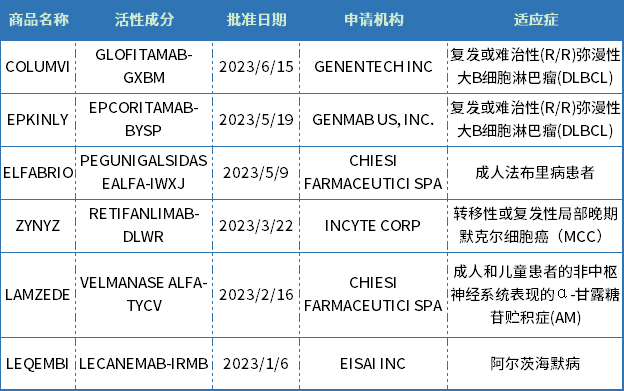
资料来源:美国FDA官网、药智数据
截至6月25日,CDER批准了6款生物药新药,包括2款单克隆抗体(LEQEMBI、ZYNYZ),2款酶替代疗法(LAMZEDE、ELFABRIO)、2款双抗(COLUMVI、EPKINLY)。此外,CDER还批准了修乐美生物类似药YUFLYMA,和Vyvgart Hytrulo皮下注射新剂型。
从治疗领域来看,生物药与化药有所不同,主要集中在肿瘤、罕见病、自免免疫领域,其中肿瘤新药占比近半。
从申报企业来看,CHIESI FARMACEUTICI SPA两款罕见病新药获得批准,罗氏的 CD3/CD20 双抗、卫材的AD新药LEQEMBI获得美国FDA加速批准上市,生物技术公司GENMAB、INCYTE也有收获。
下面简要介绍这几款获批上市的生物药。
EPKINLY由AbbVie和Genmab共同开发的一款CD3/CD20双抗,是FDA批准的首款用于治疗成人复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)患者的双特异性抗体。
COLUMVI与EPKINLY一样,也是一种靶向CD20和CD3的双特异性抗体,由罗氏旗下基因泰克开发。值得一提的是,罗氏此前已有一款CD20/CD3双抗上市产品Lunsumio,Columvi是其第二款上市的CD20/CD3双抗。
ZYNYZ是Incyte公司开发的一款人源化抗PD-1单克隆抗体,获批用于治疗转移性或复发局部晚期默克尔细胞癌(MCC)成人患者。
LEQEMBI是近些年FDA获批第二款治疗阿尔兹海默症的药物,它是一种针对聚集的可溶性(原纤维)和不溶性淀粉样蛋白(Aβ)的IgG1单克隆抗体。今年1月6日FDA通过加速审批途径批准了LEQEMBI,6月9日药物咨询委员会(PCNS)全票通过了卫材的3期Clarity AD临床试验数据证实LEQEMBI的临床益处,传统批准的PDUFA行动日期为7月6日,该药物在美国的市场定价为2.65万美元/年,这要比阿杜卡玛单抗5.6万美元/年便宜近3万美元/年。
Chiesi公司有两款罕见病药物上市ELFABRIO和LAMZEDE,均为酶替代疗法。ELFABRIO是α-半乳糖苷酶的工程版本,是一种水解溶酶体中性鞘糖脂特异性酶,被转运到溶酶体后,发挥酶活性减少累积的Gb3,用于治疗法布里病。
LAMZEDE是人α-甘露糖苷酶的重组形式,旨在为人体补充天然α-甘露糖苷酶,该酶参与降解富含甘露糖的寡糖,以防止其在体内各种组织内蓄积。
02
细胞与基因疗法加速崛起
今年上半年,CBER批准了10款生物制品,包括两款基因疗法(VYJUVEK和Elevidys),一款同种异体干细胞移植疗法(OMISIRGE),一款口服微生物群疗法(VOWST),一款重组蛋白药物(ALTUVIIIO)、一款RSV疫苗(ABRYSVO)。适应症主要集中在罕见病、抗感染领域。
表3 CBER批准的生物制品
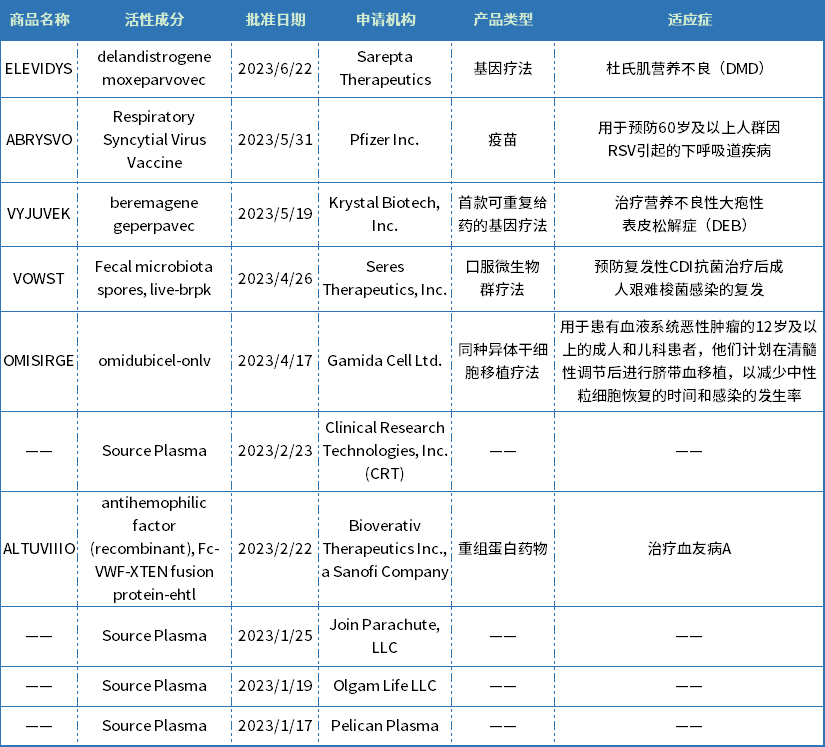
资料来源:美国FDA官网、药智数据
OMISIRGE是一种烟酰胺修饰的同种异体细胞疗法,来源于脐带血,FDA批准用于患有血液系统恶性肿瘤的12岁及以上的成人和儿童患者,计划在清髓性调节后进行脐带血移植,以减少嗜中性粒细胞恢复的时间和感染的发生率。OMISIRGE获得了FDA的突破性治疗指定、优先审评和孤儿药物指定。
VYJUVEK(beremagene geperpavec)是Krystal Biotech公司研发的一款使用单纯疱疹病毒(HSV)载体的基因疗法,是首个FDA批准的外用基因疗法,也是首款可重复的基因疗法,用于治疗营养不良性大疱性表皮松解症(DEB)。DEB是一种罕见病,该病会影响皮肤和黏膜组织,病因由COL7A1基因中一个或多个突变引起,DEB患者缺乏功能性锚定纤维,导致皮肤极度脆弱,轻微摩擦或创伤就会起泡和撕裂。VYJUVEK旨在为患者的皮肤细胞提供两个COL7A1基因的正常拷贝,生成功能性VII型胶原蛋白(COL7)蛋白。VYJUVEK预计将于2023年第三季度在美国上市,据报道Vyjuvek每瓶的价格为24250美元,每位患者每年需26瓶,年费约为63万美元,经过政府强制折扣后为48.5万美元。
Elevidys是由Sarepta Therapeutics和罗氏联合开发的一款基因疗法,也是首个通过加速批准上市的体内基因疗法,被批准用于治疗杜氏肌营养不良(DMD)。DMD是一种知名的罕见X连锁退行性神经肌肉疾病,其发病是由于患者体内编码抗肌萎缩蛋白(dystrophin)的基因发生变异,导致抗肌萎缩蛋白的缺失或功能缺陷,大约每3500-5000例男婴中就有一例DMD患者。
03
小结
今年上半年,美国FDA批准的新药主要集中在抗肿瘤、神经系统、抗感染以及罕见病领域。过去几年,肿瘤药一直在CDER批准名单中占主导地位,但是从今年上半年的审批情况来看,抗肿瘤药物热度有些许下降,慢病领域热度上涨。在FDA的政策鼓励下,药企对罕见病治疗药物的研发热情依然高涨,是近年来新药产出最主要的领域之一。
另外,过去20年投入巨大的阿尔茨海默病领域终于迎来了突破,卫材的LEQEMBI获加速批准上市,礼来的donanemab 3期临床试验成功。
下半年FDA又会批准哪些药物呢,我们拭目以待!
参考资料
1. 一波三折,这种百年怪病的首款疗法是如何诞生的?
2. EPKINLY™ (epcoritamab-bysp) Approved by U.S. FDA as the First and Only Bispecific Antibody to Treat Adult Patients with Relapsed or Refractory Diffuse Large B-Cell Lymphoma (DLBCL).
3. FDA Advisory Committee Votes Unanimously to Confirm the Clinical Benefit of LEQEMBI® (lecanemab-irmb) for the Treatment of Alzheimer’s Disease.
4. 各企业官网、FDA官网以及药智数据等公开信息。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..