近日,国家药品监督管理局药品审评中心(CDE)公示了新一批“拟突破性治疗品种”,科伦博泰创新TROP2-ADC(SKB264,MK-2870)再度上榜,拟用于既往接受过至少二线系统化疗的局部晚期或转移性激素受体阳性(HR+)和人表皮生长因子受体2阴性(HER2-)的乳腺癌。

SKB264是一款靶向TROP2的抗体药物偶联物(ADC),已分别就局部晚期或转移性三阴乳腺癌(TNBC)和EGFR-TKI 治疗失败的局部晚期或转移性EGFR 突变非小细胞肺癌(EGFRm NSCLC)被授予两项突破性疗法认定(BTD)。据医药魔方统计,此次公示预示着SKB264有望成为TROP2-ADC中首个在我国收获三项BTD的创新产品。
科伦博泰作为国内ADC开发企业的翘楚,近年来收获颇丰。在项目合作方面,与默沙东达成至多9个ADC项目,前期及里程碑付款合共高达118亿美元的合作,成为国产创新药史上的闪亮记录。在产品开发方面,A166率先提交上市申请,有望成为国内首款治疗HER2阳性乳癌的国产ADC;如今,SKB264有望三度囊获BTD荣誉,将再一次创造国产TROP2-ADC的荣耀时刻。不禁令人好奇,这样的成绩究竟是产品开发速度奠定的基础,还是药物临床价值塑造的优势?
SKB264开发进度全球领先
突破性疗法认定是为了鼓励研究和创制具有明显临床优势的药物而设定的一项药物审评工作程序,需要药物在临床试验期间对用于防治严重危及生命或者严重影响生存质量的疾病且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势,才能授予突破性疗法认定。
CDE授予SKB264 BTD认定,足以说明对该药临床价值的认可。放眼整个创新药领域(含进口产品),能够荣获三项BTD认定者也是寥寥无几。
同时,对纳入突破性治疗品种名单的药物,CDE将优先配置资源进行沟通交流,加强指导并促进药物研发。经评估符合相关条件的,也可以在申请药品上市许可时提出附条件批准和优先审评审批申请。从药物开发周期的角度考虑,获得BTD之后有望缩短审评审批期间的排队时间,这无疑有助于加速SKB264的上市进程,更早解决中国患者的未满足临床需求。
事实上,SKB264的开发进度已经是国产TROP2-ADC中的佼佼者。根据医药魔方数据,SKB264是国产TROP2-ADC中当前唯一进入临床III期研究的药物。
TROP2 ADC上市及临床在研产品列表(来源:NextPharma)

更加值得关注的是,SKB264在部分适应症中也做到了全球同步,呈现出齐头并进的态势。5月23日,科伦博泰在临床试验公示平台登记了一项评估SKB264单药对比培美曲塞联合铂类治疗经表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)治疗失败的EGFR突变的局部晚期或转移性非鳞NSCLC的随机、开放性、多中心Ⅲ期临床研究(CTR20231535)。这是首项针对EGFR突变 NSCLC开展Ⅲ期临床研究的TROP2-ADC,标志着SKB264在EGFR突变NSCLC领域步入全球前列。
此前,SKB264也启动了一项针对至少接受过2线治疗的局部晚期、复发或转移性三阴性乳腺癌患者的III期试验(CTR20220878)。除戈沙妥珠单抗之外,这也是国内同类产品在该疾病领域中唯一的一项注册性研究。同时,SKB264还在中美两地开展了一项涵盖乳腺癌、非小细胞肺癌、胃癌、头颈鳞癌和尿路上皮癌等多种实体瘤的篮子式临床试验(NCT04152499),为后续全球III期研究铺平了道路。
可以说,无论是从临床价值角度还是开发速度考虑,SKB264都有着鲜明的优势。或许,正是这样的优势吸引了默沙东的青睐,为SKB264的国际化征程注入强劲助力。
创新设计奠定临床获益基础
出海和国际化是时下国产创新药的讨论焦点。然而,出海东南亚、一带一路,还是占据全球绝大多数医疗资源的美欧市场,其玩法却也有所不同。
我们看到,当面对FDA的“灵魂拷问”时,国产创新药的结局不尽相同,其核心是研究数据能否经得起临床价值的考验,本质上检验的是药物设计的差异性。
SKB264采取了中等毒性载荷高DAR的设计策略,利用专有的Kthiol连接技术和可裂解Linker将靶向TROP2的赛妥珠单抗与拓扑异构酶I(TOPO1)抑制剂KL610023(新型贝洛替康衍生物)偶联。其中,SKB264中使用的有效载荷和连接子结构都有助于提高ADC的稳定性,从而保证药物活性。Kthiol 药物连接技术,可以通过形成不可逆共价结合避免了同类产品中马来酰亚胺与半胱氨酸可能发生的逆“Michael加成”导致的载荷脱落,改善了ADC稳定性,以及减少脱靶毒性。同时,采用肿瘤专有酶裂解的Linker片段,利用酸性肿瘤微环境选择性地向肿瘤组织释放细胞毒性载荷,又避免了在靶脱瘤毒性。

差异化的设计需要数据来验证。根据科伦博泰招股书披露的数据,SKB264在细胞系衍生异种移植物(CDX)模型中,相对于同剂量(3 mg/kg)的戈沙妥珠单抗,血浆中有效载荷暴露水平相当,但SKB264在肿瘤组织中的有效载荷暴露约高4.6倍[1]。

来源:科伦博泰招股书
相同给药剂量,但在肿瘤中更高的毒性载荷暴露,这样的趋势或表明SKB264可能具有更高的抗肿瘤效力和安全性潜力。在不同的CDX模型中,SKB264相较于戈沙妥珠单抗,可以达到更高的肿瘤生长抑制(TGI)和消退。

来源:科伦博泰招股书
这种趋势在临床研究中也开始逐步显现。近期,美国临床肿瘤学会(ASCO)年会上公布了SKB264用于EGFR突变NSCLC患者末线治疗的研究数据。结果显示[2],在39名可进行疗效评估的患者中,SKB264的ORR达到43.6%,DCR为94.9%,中位DoR为9.3个月。对于EGFR野生型亚组(先前接受包括抗PD-(L)1治疗在内的中位2线治疗),ORR为26.3%,DCR为89.5%,中位PFS为5.3个月。在TKI耐药的EGFR突变NSCLC亚组(一线化疗失败患者占50%)中,ORR为60.0%,DCR为100%,中位PFS为11.1个月。

来源:2023 ASCO
可以说,相对于目前同类已上市或处于临床后期的产品,SKB264在EGFR突变NSCLC中具有更好的数据表现。同样,在TNBC末线患者中,SKB264相对于戈沙妥珠单抗和DS-1062,展示了更高的ORR数据(非头对头研究),分别为43.6%、35%和32%。其中,SKB264在TROP2高表达的患者中,确认的ORR(cORR)更是达到55.2%[1]。
在HR+/HER2-乳腺癌中,根据科伦博泰招股书披露的截至2022年11月15日的数据[1],可进行疗效评估的28名患者确定的ORR为42.9%(12/28),DCR为85.7%(24/28),相对于同类产品也是有着更好的潜力。

来源:科伦博泰招股书
安全性方面,根据科伦博泰招股书披露的截至2022年11月15日的数据显示[1],SKB264也有不俗表现。相对于戈沙妥珠单抗,SKB264中性粒细胞计数降低、淋巴细胞计数降低以及腹泻等不良事件的发生率较低,而与接受DS-1062治疗的患者(间质性肺病所有级别为6%及3级或以上为2%)比较,未观察到治疗相关的间质性肺病,令其有了明显的安全性差异。
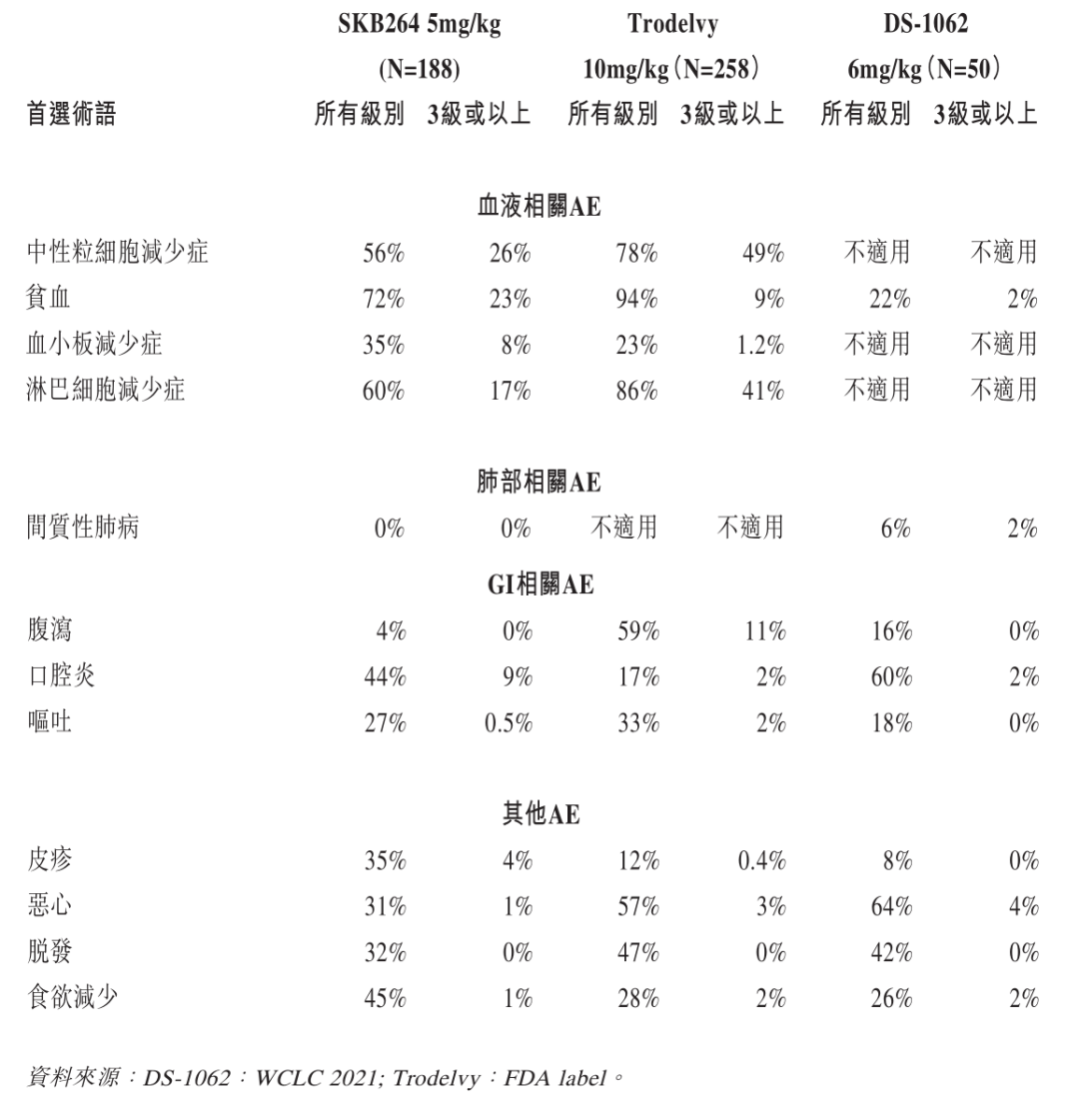
来源:科伦博泰招股书
当然,上述有效性和安全性数据并非头对头的研究,但相关药物在临床中表现出的有效性和安全性数据,也能够在一定程度上反映其差异化特征及潜在优势以及面对标准疗法时的竞争潜力。
创新药出海无法逃避标准疗法的挑战,但在已经或有望获得BTD认证的EGFR突变NSCLC、TNBC以及HR+/HER2-BC领域,可以说SKB264单药也是具备了挑战潜力,而其安全性特质更有望助益与免疫疗法的联合应用。ADC联合免疫疗法,不仅能够实现直接杀死或抑制癌细胞的增殖,还可以通过激活T细胞、自然杀伤细胞等免疫细胞来增强免疫疗法的抗肿瘤效应,解决耐药性并获得更持久的治疗效果。SKB264联合A167(anti-PD-L1单抗)在晚期TNBC患者中作为一线疗法的ORR达到了85.7%[1],也让我们看到了TROP2 ADC联合PD1/L1 免疫疗法的潜力。
如果说,TROP2-ADC联合抗PD-1/L1单抗的潜质是默沙东看上SKB264的直接原因。那么,SKB264的临床潜力就是促使默沙东加速推进国际多中心临床研究的底气。近期,默沙东表示,将在2023年启动SKB264(MK-2870)在肺癌和乳腺癌中的临床III期研究。
![]()
来源:MSD ASCO Investor Event
差异化的创新药设计理念,必须接受临床实践的验证,而SKB264也需要在III期临床研究中为自身赢得认可。不过,就SKB264目前表现的临床价值,叠加开发速度优势和BTD的政策支持,无疑为该药在市场竞争中带来先天优势。
临床价值塑造商业潜力
肺癌和乳腺癌在国内乃至全球范围内仍然是最为常见的恶性肿瘤。
根据国际癌症研究机构(IARC)数据[3],乳腺癌和肺癌是全球最高发的两类恶性肿瘤,2022年发病人数分别为226万和221万;其中,肺癌导致180万例死亡,是全球死亡人数最多的恶性肿瘤。在中国[4],肺癌也是发病人数和死亡人数均排第一的恶性肿瘤,2020年发病人数和死亡人数分别为81万和71万;2020年,国内乳腺癌发病人数超41万,是女性患者中发病人数最高的恶性肿瘤,严重威胁着民众健康。
庞大的患者群体也就决定了抗肿瘤药的市场规模。近年来,ADC药物作为明星赛道,其市场规模也在逐年增大,已由2017年的16亿美元增长至2022年的72亿美元,并预计以31.2%的复合年增长率持续快速增长。同样,中国的ADC市场也会随着药物获批数量的增多而逐年提高,预计将以复合年增长率79.4%的速度在2030年达到689亿元,其中TROP2 ADC药物将占据236亿元的市场规模[1]。
TROP2作为在多种癌症(如BC(TNBC及HR+/HER2- BC)、NSCLC、GC及OC)中普遍过度表达的肿瘤特异性抗原,具有广泛的适应症基础。当然,对于每一种具体的抗肿瘤药物而言,其临床价值也将在一定程度上决定其市场潜力。
HR+/HER2–乳腺癌是最常见的乳腺癌亚组,约占全部乳腺癌病例的70%[5]。此次,SKB264获得HR+/HER2-乳腺癌的BTD认定,加之此前在TNBC(约占乳腺癌15%)适应症上的BTD认定,标志着SKB264有望在乳腺癌领域获得更广泛的应用空间。
内分泌治疗是美国及中国晚期HR+/HER2-乳腺癌的主要治疗方法。然而,据估计,40%-50%的晚期HR+/HER2-BC患者对内分泌治疗有耐药性。内分泌治疗难治的患者目前可用的有效治疗选择有限,对有效的基于非内分泌疗法的治疗存在巨大的临床需求。而TROP2在HR+/HER2-BC中过度表达,令靶向TROP2的ADC药物成为潜在的治疗手段。戈沙妥珠单抗是当前美国唯一获批用于治疗晚期HR+/HER2-乳腺癌的TROP2-ADC,目前已成为年销售额超6亿美元的创新产品,并预计将在2028年达到28亿美元。
毫无疑问,戈沙妥珠单抗的成功为TROP2-ADC的开发树立了典范与榜样。而SKB264作为首个在TNBC、EGFR突变NSCLC等领域率先开启多项III期临床开发的国产TROP2 ADC,则有望挑起国产TROP2 ADC大旗,未来将展现怎样的商业价值也是令人充满期待。
[1] 科伦博泰招股书:
https://www1.hkexnews.hk/app/sehk/2023/105187/documents/sehk23060400037_c.pdf
[2] 2023 ASCO:abstract 9114
[3]https://www.who.int/news-room/fact-sheets/detail/cancer
[4]https://gco.iarc.fr/today/data/factsheets/populations/160-china-fact-sheets.pdf
[5]Cancers (Basel),2022 ,14(8): 1898;
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..