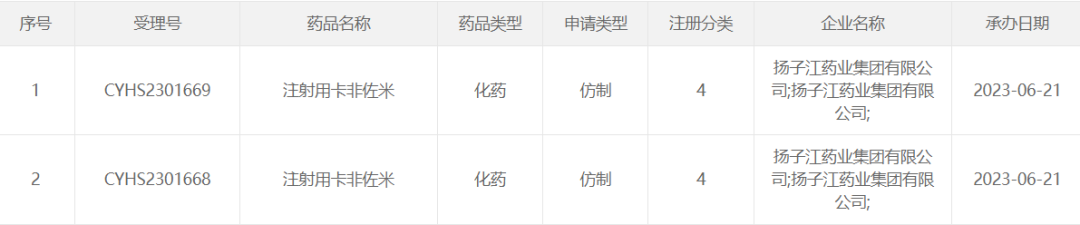
近日,国家药品监督管理局官网显示,扬子江药业以仿制4类提交的注射用卡非佐米上市申请获得CDE承办受理。目前,国内注射用卡非佐米首仿尚未决出。
卡非佐米是新一代的高度选择性不可逆蛋白酶体阻断药,属于环氧甲酮四肽蛋白酶体抑制剂类似物,主要抑制20S蛋白酶体的糜蛋白酶,适用于治疗多发性骨髓瘤。
多发性骨髓瘤(Multiple myeloma,MM)是一种由克隆性浆细胞异常增殖导致的恶性疾病,多发于中老年人,目前仍无法治愈,且容易复发。若得不到及时治疗,会出现骨髓衰竭、骨质破坏、高钙血症、贫血、感染、肾衰竭等症状,威胁患者长期生存。
卡非佐米的结构和作用机理不同于二肽硼酸类似物硼替佐米,硼替佐米与蛋白酶体的催化β5亚组可逆性结合,而卡非佐米不可逆共价结合蛋白酶体的催化β5亚组和免疫蛋白酶体β5i(LMP7)亚组,相比于硼替佐米具有更好的效力和耐药性。
2021IMWG建议、2023年NCCN指南、中国CSCO指南及《中国多发性骨髓瘤诊治指南(2022修订)》等多个国内外权威指南均推荐以卡非佐米为基础的方案用于治疗首次复发的MM。专家预计其可能会取代硼替佐米,国内市场潜力巨大。
卡非佐米最初由Proteolix公司研发,2009年奥尼克斯(Onyx)收购Proteolix后获得该品种,2013年8月安进收购奥尼克斯制药公司,并获得卡非佐米的专利权。
2012年7月,卡非佐米首获美国FDA批准上市,商品名为Kyprolis,是继硼替佐米后,被美国FDA批准为第二个蛋白酶体抑制剂,用于治疗之前接受至少2种药物(包括硼替佐米和免疫调节剂治疗)的多发性骨髓瘤患者。
2021年7月9日,国家药品监督管理局附条件批准注射用卡非佐米(商品名:凯洛斯,Kyprolis)上市,与地塞米松联用,治疗复发或难治性(R/R)多发性骨髓瘤(MM)成人患者,患者既往至少接受过2种治疗,包括蛋白酶体抑制剂和免疫调节剂。另外,2019年11月,百济神州与安进达成战略合作,获得凯洛斯在中国的授权。
今年1月份,凯洛斯(注射用卡非佐米)通过医保谈判进入2022年国家最新医保目录,用于复发或难治性多发性骨髓瘤(RRMM)成人患者。
![]()
(来源:CDE官网)
目前卡非佐米已在全球多个国家上市,上市后销售额稳定上涨,根据相关财报,2021年安进的卡非佐米(Kyprolis)全球销售额为11.08亿美元,2022年全球销售达12.47亿美元,同比增长13%。值得注意的是,2023年第一季度卡非佐米的成绩十分亮眼,销售额高达3.58亿美元,创下单季度销售纪录,同比增长25%。
国内方面,2022年1月5日,卡非佐米正式在国内上市供应,根据百济神州财报,2022年销售额接近1亿元,为9133.5万元。
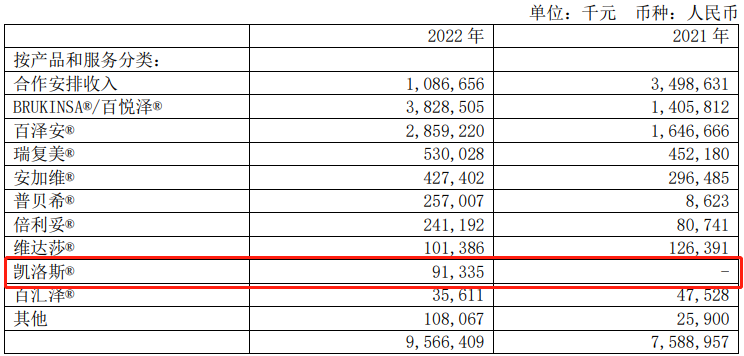
(来源:公司财报)
目前国内一共有6家企业报产注射用卡非佐米。
2021年9月7日,豪森药业的注射用卡非佐米(仿制3类)申报上市并获承办。豪森药业是国内最早进行仿制申报的企业,而且豪森药业此前对原研作出专利挑战,但国家知识产权局作出维持专利有效的两件审查决定。以目前情况来看,尽管进度最快,但就算夺得首仿,豪森药业的卡非佐米仿制药或许也要等待到2025年两件涉案专利到期后才能上市销售。
另外,从2022年下半年至今,上海创诺制药、齐鲁制药、四川汇宇制药、昆山龙灯瑞迪制药和扬子江药业也相继报产(仿制4类),预计不久后将进入注射用卡非佐米仿制竞争的白热化阶段。
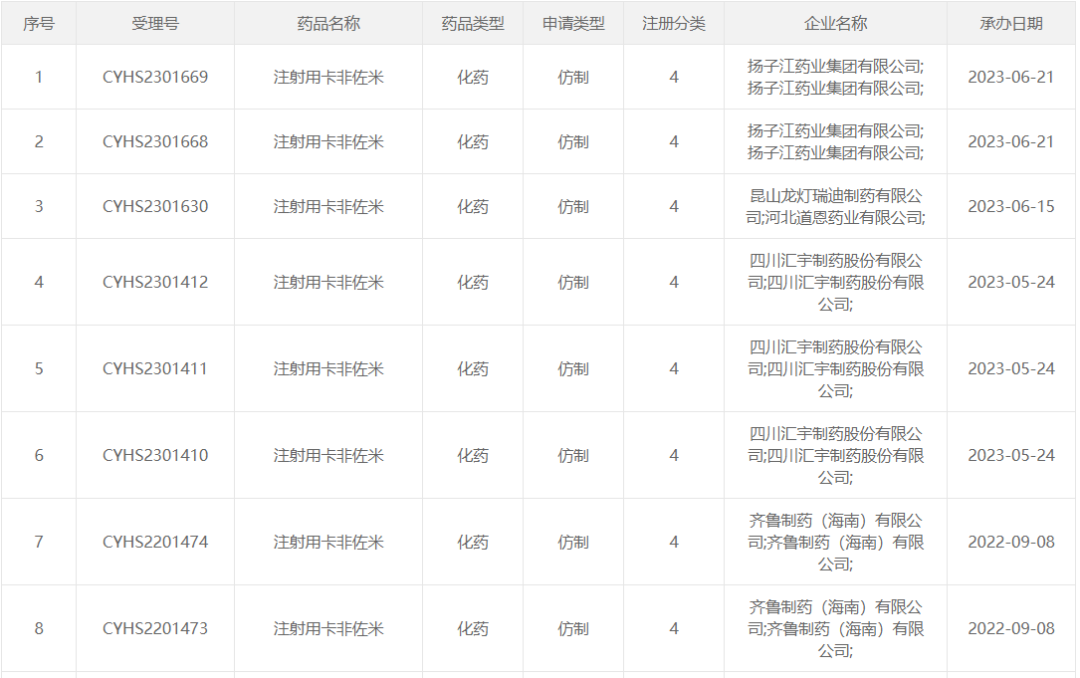
(来源:CDE官网)
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..