近日,辉瑞430亿美元收购Seagen的新闻再次拉升了行业对ADC赛道的关注度。这是ADC领域有史以来规模最大的交易,同时也是又一个制药巨头重磅下注ADC的标志性事件。
ADC药物市场规模在近几年正以双位数的增速不断扩大,2022年已达到近73亿美元(+32.9%)。罗氏Kadcyla(恩美曲妥珠单抗,HER2 ADC)和Seagen/武田Adcetris(维布妥昔单抗,CD30 ADC)凭先发优势仍占据较大市场份额,不过近两年随着更多ADC产品实现商业化,这两款药物占比也逐年降低。相反地,注射用德曲妥珠单抗(优赫得®,ENHERTU)却在上市后的第3年已占据ADC市场17%的份额,2022年实现了12.38亿美元的销售收入,同比增长190%。该产品全球由第一三共和阿斯利康联合开发推广,同时第一三共拥有该产品在日本独家商业化权益。
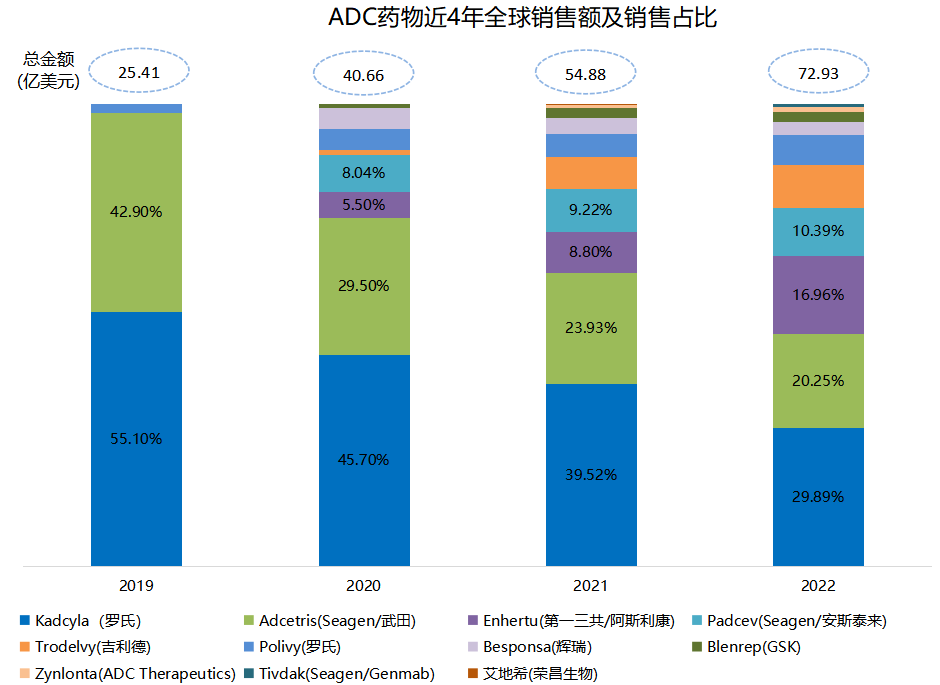
来源、各公司财报、医药魔方
近日,注射用德曲妥珠单抗成功获国家药品监督管理局(NMPA)批准上市,用于治疗HER2+晚期乳腺癌患者。就在前天(3月27日),注射用德曲妥珠单抗再下一城,在日本获批用于治疗HER2低表达晚期乳腺癌患者,这也是其3年内在日本获批的第三个适应症。无论是该药物所使用的ADC技术还是临床试验所显示的疗效数据,都是业内人士讨论的热门话题。注射用德曲妥珠单抗既不是首个获批的ADC,也不是首款HER2靶向药物,为何会引起行业广泛关注?
此前发表在Nature上的一篇文章报道,预计到2026年,全球已上市ADC药物的市场规模将超过164亿美元。而注射用德曲妥珠单抗将以62亿美元的销售额位居第一位[1]。
无论是注射用德曲妥珠单抗万众瞩目的行业地位,还是分析师对其极其乐观的前景,背后的原因都需要我们回归到产品本身去分析和挖掘。
HER2 ADC——引领HER2表达乳腺癌
治疗变革
HER2阳性(HER2+)转移性乳腺癌约占所有乳腺癌亚型的20%[2]。此前,化疗是这类患者的标准疗法。1998年,FDA批准首款HER2靶向疗法曲妥珠单抗上市,从此改变了这类患者的治疗模式。曲妥珠单抗不仅将HER2+转移性乳腺癌患者的存活率提高至30%以上,也推动了临床变革,使HER2+乳腺癌治疗进入靶向和个性化治疗时代。
近十多年来,多款新药的批准扩大了HER2+乳腺癌患者的用药选择,治疗场景也逐渐从晚期向早期辅助/新辅助前移。截止目前,获批用于HER2+乳腺癌的药物类型呈现出小分子、单抗、ADC齐头并进的态势,而ADC药物的表现尤为惊艳。
基因泰克与ImmunoGen合作开发并于2013年2月上市了首个抗HER2 ADC药物恩美曲妥珠单抗。EMILIA研究中,相较于拉帕替尼和卡倍他滨,恩美曲妥珠单抗显著延长了患者生存时间,中位总生存期(mOS)达到30.9个月(HR=0.682)[3]。临床研究的突破也最终转化为真实世界治疗的变革,恩美曲妥珠单抗成为了国际公认的HER2+晚期乳腺癌标准二线治疗药物。
注射用德曲妥珠单抗作为备受瞩目的新一代ADC药物,自2019年圣安东尼奥乳腺癌研讨会(SABCS)中DESTINY-Breast01研究数据惊艳亮相以来,在ADC界风头无两。与标准疗法恩美曲妥珠单抗的头对头III期DESTINY-Breast03研究大获全胜再次使其声名鹊起。SABCS22会议公布的最新结果显示[4],与对照组相比,注射用德曲妥珠单抗显著延长HER2+晚期乳腺癌患者中位无进展生存期(mPFS,28.8 vs 6.8个月),降低疾病进展或死亡风险67%,且所有亚组中注射用德曲妥珠单抗治疗均取得明显PFS获益。
此外,关键次要终点OS也达到了统计学意义的显著差异,与对照组相比,注射用德曲妥珠单抗组患者死亡风险降低了36%,虽然两个治疗组均未到达中位OS;但是随着随访时间的延长,患者OS获益有进一步扩大的趋势。值得指出的是,注射用德曲妥珠单抗组21.1%的患者获得基于RESCIST1.1标准评估的完全缓解(CR),比对照组提升一倍。
DESTINY-Breast03是全球众多HER2 ADC药物中首个开展与标准疗法恩美曲妥珠单抗头对头比较的III期研究,注射用德曲妥珠单抗的胜出意味着晚期HER2+乳腺癌二线治疗策略将被重新定义。国内外HER2 ADC同类产品的竞争或将提前打响,尤其处于临床早期的产品,时间窗和临床优势也需要重新考量。特别是头对头研究,未来的对照药选择也可能会有所不同。
另一方面,注射用德曲妥珠单抗惊艳的疗效数据也使我们对晚期乳腺癌治疗进行更多思考。随着科学和技术的革新以及更优疗法的出现,这类患者将实现更长时间的生存获益。
DESTINY-Breast03之外,注射用德曲妥珠单抗单药或联合帕妥珠单抗与标准治疗(THP: 多西紫杉醇或紫杉醇联合曲妥珠单抗和帕妥珠单抗)头对头一线治疗HER2+晚期乳腺癌III期DESTINY-Breast09研究正在进行中。相信在不远的将来,注射用德曲妥珠单抗或将成为占据一线治疗地位20年的曲妥珠单抗的有力补充。
注射用德曲妥珠单抗在HER2+晚期乳腺癌二线治疗中的突破不言而喻,然而在所有转移性乳腺癌患者中,HER2+患者(IHC 3+,IHC 2+/ISH+)仅占20%,而HER2低表达者(IHC 2+/ISH-,IHC 1+)约占50%。[5,6]针对HER2低表达患者,现有的HER2靶向药物未能显示出明显获益。注射用德曲妥珠单抗不仅打破了只有HER2+乳腺癌能从抗HER2治疗中获益的传统认知,更是终结了自HER2被发现以来的HER2+和HER2-二分法时代,革新了转移性乳腺癌的分类和治疗方式。
2022 ASCO大会上公布的DESTINY-Breast04研究结果再次惊艳四座,与医生选择的标准化疗方案相比,注射用德曲妥珠单抗在经治激素受体阳性(HR+)或HR-、HER2低表达不可切除和/或转移性乳腺癌患者的PFS和OS方面表现出优越且具有临床意义的显著改善。注射用德曲妥珠单抗显著延长了HR+、HER2低表达转移性乳腺癌患者中位PFS(10.1个月 vs 5.4个月),将疾病进展或死亡风险降低了49%(HR:0.51;95% CI:0.40-0.64;p<0.001),患者中位OS也显著延长(23.9个月 vs 17.5个月)。在HR-人群中,注射用德曲妥珠单抗组和化疗组的中位PFS分别为8.5个月和2.9个月(HR=0.46),中位OS分别为18.2个月和8.3个月(HR=0.48)。
基于DESTINY-Breast04研究数据,2022年6月,注射用德曲妥珠单抗被纳入NCCN指南,作为既往至少接受过一种化疗方案的HER2低表达晚期乳腺癌患者的1类首选方案。2022年8月,FDA通过实时肿瘤学审评(RTOR)和奥比斯计划(Project Orbis)批准该适应症,比预定的日期提前了4个月。目前针对该适应症的sBLA申请已获国家药监局药审中心受理,正在审评中,预计将在年内获批。
ADC新药在HER2+晚期乳腺癌患者中的表现让我们不难猜测到其针对早期乳腺癌的布局。罗氏恩美曲妥珠单抗已获得了HER2+早期乳腺癌患者的辅助治疗资格。同样的,满足更多早期乳腺癌患者的临床需求也是注射用德曲妥珠单抗的目标。目前,与恩美曲妥珠单抗头对头辅助治疗HER2+早期乳腺癌的III期DESTINY-Breast05研究正在进行中,而新辅助治疗HER2+早期乳腺癌的DESTINY-Breast11研究也在计划中。注射用德曲妥珠单抗未来是否可以“制霸”乳腺癌领域值得更多的期待和遐想。
总的来说,曲妥珠单抗的上市使HER2+乳腺癌进入靶向治疗时代,恩美曲妥珠单抗的出现开启了HER2 ADC治疗HER2+乳腺癌的先河,而注射用德曲妥珠单抗则具有青出于蓝而远胜于蓝的特质,头对头恩美曲妥珠单抗的III期成功不仅重新定义了HER2+晚期乳腺癌二线治疗标准,在HER2低表达晚期乳腺癌患者中展现出的优异疗效则重新定义了转移性乳腺癌的分类和治疗方式,是乳腺癌治疗史上的里程碑。未来,随着更多研究结果的公布,注射用德曲妥珠单抗在乳腺癌治疗中的基石地位或将显现。
乳腺癌之外,HER2 ADC实现重大突破
研究发现,HER2蛋白不仅在乳腺(称为HER2+乳腺癌)肿瘤表面过度表达且与更具侵袭性的疾病和不良预后有关。此外,HER2过表达、扩增和突变也在多种其他类型实体瘤中得到确认,包括胃癌和胃食管交界处(GEJ) 癌、胆道癌 (BTC)、结直肠癌 (CRC)、非小细胞肺癌 (NSCLC) 和膀胱癌等[7]。
图片不同肿瘤类型中HER2基因改变情况(来源:参考资料[7])
相较于HER2+乳腺癌患者,其他癌种HER2+实体瘤患者的治疗选择比较有限。不过,近年来,这类患者也逐渐迎来了新疗法。
2010年,曲妥珠单抗相继在欧盟、美国获批,联合化疗一线治疗HER2+转移性胃癌或胃食管交界处腺癌患者,成为了胃癌领域获批的首款HER2靶向疗法;2021年1月,凭II期DESTINY-Gastric01 研究数据,注射用德曲妥珠单抗获FDA批准用于既往接受过基于曲妥珠单抗治疗的局部晚期或转移性HER2+胃或胃食管交界处腺癌患者,成为了全球首款获批治疗HER2+胃癌患者的ADC新药。
同年,荣昌生物ADC新药维迪西妥单抗在中国获批,用于至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌和胃食管结合部腺癌患者的治疗。至此,胃癌领域已经成为HER2 ADC新药的另一个“战场”。注射用德曲妥珠单抗虽还未在国内递交sBLA,不过II期临床正在进行中,中国胃癌市场庞大,注射用德曲妥珠单抗也是势在必得。
2022年8月,注射用德曲妥珠单抗获FDA加速批准用既往接受过系统治疗的无法切除或转移性HER2+非小细胞肺癌成人患者,跃升为全球首款也是唯一一款用于HER2+非小细胞肺癌的靶向疗法,再次创造了肺癌治疗领域的里程碑。
尿路上皮癌领域,荣昌生物维迪西妥单抗已在中国获批用于治疗既往接受过含铂化疗且HER2过表达(IHC 2+或3+)的局部晚期或转移性尿路上皮癌患者,不过注射用德曲妥珠单抗针对这一人群也有布局。
除了上文提到的几类HER2突变实体瘤患者外,其余的HER2表达肿瘤患者目前尚无可用的靶向疗法。值得注意的是,注射用德曲妥珠单抗针对多癌种HER2表达、既往接受过多种方案治疗晚期实体瘤患者的DESTINY-PanTumor02研究也已于近期达到了客观缓解率(ORR)的主要终点。这项全球性、多中心、开放标签、多队列II期研究共包括了胆道癌、尿路上皮癌、宫颈癌、子宫内膜癌、卵巢癌、胰腺癌和罕见癌症7个队列。该研究的详细结果将于近期提交至全球监管机构。
总的来说,不同于HER2+乳腺癌患者目前已拥有众多治疗药物。其他携带HER2改变肿瘤患者的治疗选择十分有限。不过HER2 ADC药物的出现已使部分患者有了新的治疗选择。而注射用德曲妥珠单抗在泛HER2表达肿瘤患者中表现出的积极临床结果也使其造福更多HER2表达实体瘤患者提供了无限可能。
总结
药物开发的目标是患者获益,反过来,能真正造福于患者的产品也将得到市场认可。ADC药物的出现无疑推动肿瘤治疗迈向了一个新的台阶,展现出无限潜能。这也促使国内外众多企业投身于到这一赛道,无论是跨国药企罗氏、阿斯利康、第一三共、辉瑞,还是国内企业荣昌生物、科伦博泰、恒瑞医药均有布局。HER2 ADC药物无论是一路狂飙的市场规模,还是布局的疾病领域,远远走在了其他ADC药物的前列。从乳腺癌到胃癌、非小细胞肺癌,再到尿路上皮癌......HER2 ADC新药在不断探索中前行。而在HER2 ADC赛道,注射用德曲妥珠单抗是最耀眼的星,期待这款新药能不断突破,为更多患者带去希望。
***
- 参考资料 -
[1] Nature Reviews Drug Discovery. The oncology market for antibody-drug conjugates.
[2] Ahn S, et al. J Pathol Transl Med. 2020;54(1): 34-44.
[3] N Engl J Med. 2012 Nov 8;367(19):1783-91.
[4] #SABCS 2022 Abstract #GS2-02
[5] Tarantino P, et al. HER2-Low Breast Cancer: Pathological and Clinical Landscape. J Clin Oncol. 2020;38(17):1951-1962.
[6] Ahn S, et al. HER2 status in breast cancer: changes in guidelines and complicating factors for interpretation. J Pathol Transl Med. 2020; 54(1): 34-44.
[7] Nat RevClin Oncol 17, 33–48
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..