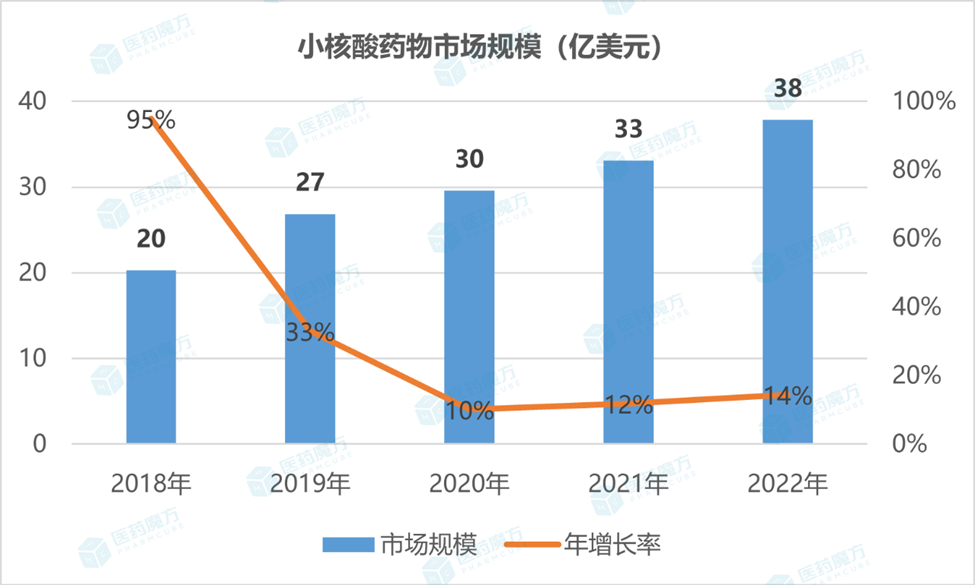
近年来,小核酸药物研发的热度持续增高,其市场当下增速较快且具备极高的发展潜力。2022年,小核酸药物市场继续保持双位数增长,市场体量已从2018年的20亿美元扩充至如今的近40亿美元,几乎翻倍。从资本的角度来看,2022年国内外围绕小核酸药物进行的投融资事件共有21起,绝大多数项目的融资金额都达上亿元人民币。
纵观小核酸药物的历史,行业的飞速发展一定程度上依赖于递送技术的出现。由于核酸是携带负电荷的生物大分子,很难通过细胞膜的表面带负电荷的脂质双分子膜层,而且RNA容易被血浆和组织中RNase酶降解,被肝脏和肾脏快速清除和被免疫系统识别,进入细胞后“卡”在内吞小体中无法发挥功能。因此,能够克服系统循环、外渗、组织渗透、细胞摄取以及内涵体逃逸等重大挑战的递送平台是小核酸领域的“卡脖子”技术,也是小核酸药物获得成功的必要条件。
递送技术的发展呈现出平台化的特点,在递送技术相对成熟后,基于相同技术平台开发类似药物的速度会明显加快。Alnylam是最早使用来自于Tekmira(现为Arbutus)授权的LNP平台进行小核酸药物开发的公司,也是最早开发GalNAc递送系统的公司。其率先在小核酸药物中采用LNP、GalNAc等递送系统,并不断加强递送技术的平台化发展,为后续的研发提供了模块化、可重复的开发模式,因此在2018年上市第一款小核酸药物Patisiran之后,4年内相继获批了5款产品,临床阶段成功率更是高达62.0%,相比整个医药行业5.7%的累计转化率高出了10倍有余。
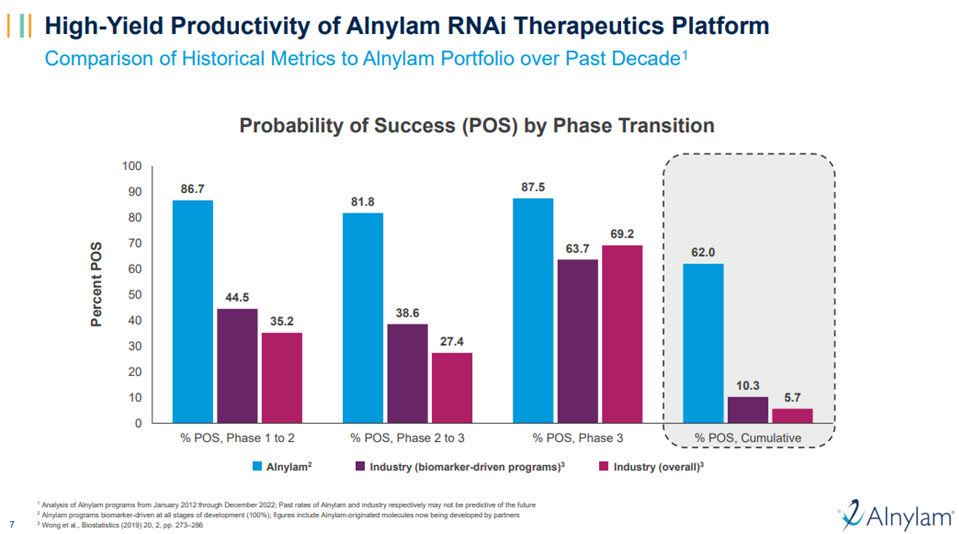
Alnylam、靶向药领域、医药行业整体在不同临床阶段的转化率
从平台型技术本身的价值而言,随着相关技术平台得到临床验证,曾经在RNAi浪潮中抽身的MNC们,近年来也纷纷积极与小核酸技术公司展开产品和技术合作,快速重建相关平台。因此,小核酸递送技术平台成为了相关企业争相布局的必争之地,小核酸相关技术尤其是递送平台的发展,一定程度上决定了一家企业的长期盈利能力。
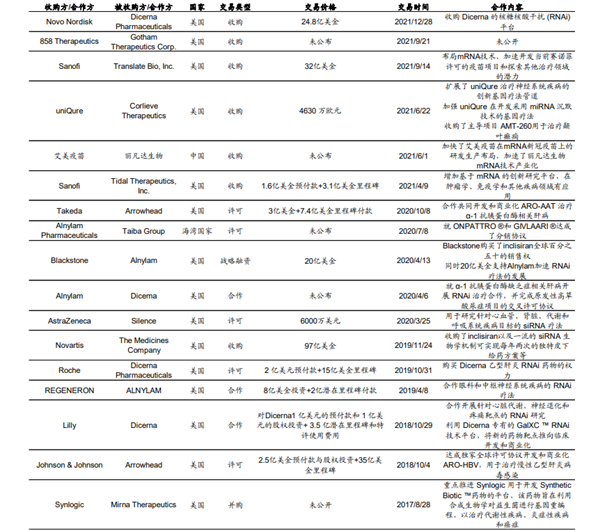
RNA 疗法相关并购交易
目前已开发出小核酸药物并实现成功上市的递送平台包括LNP(脂质纳米颗粒)平台与GalNAc共轭连接递送系统平台。然而这两种递送也存在缺陷,如LNP递送范围主要局限于肝脏和网状内皮系统(RES),且存在潜在的毒性;GalNAc偶联技术虽解决了LNP的免疫原性问题,但也存在肝靶向的局限性。
因此,现有递送技术的不足叠加极高的专利壁垒的限制下,目前业界纷纷对递送平台进行更新和尝试,既包括规避专利风险的基础上在LNP、GalNAc的分子基础上做成分和结构的更新,也包括采用新的共轭连接系统和脂质体纳米技术等新材料和新合成技术对小核酸药物进行开发,旨在进一步降低递送载体的副作用、实现器官和组织特异性靶向、提高细胞或组织靶向性、提高递送效率、创新给药方式、提供高效低成本合成制备方式,从而解决未满足的疾病治疗需求。
那么除了已经得到临床验证的LNP和GalNAc技术平台,近几年还会有哪些新型递送平台值得期待呢?以下将根据递送平台的类型(基于小分子配体偶联、纳米颗粒载体、抗体偶联、聚合物基质等),对未来几年即将迎来商业化拐点的递送技术平台 [目前已开发出临床2期(或临床1/2期并已公布数据)及以上,但未上市的的小核酸药物] 进行介绍。
递送平台类型1:基于小分子配体偶联
小分子配体偶联是指将GalNAc等小分子偶联至RNA, 可经皮下或静脉注射系统给药, 靶向能力强,可借助固有的受体介导内吞入胞。其中应用最为成熟的是 GalNAc 共轭连接递送系统,Alnylam至今已更新了3代 GalNAc技术,其中前2.5代已分别用在了四款已上市产品中。全球范围内,研发管线中约三分之一的小核酸药物基于此技术。
GalNAc(N-乙酰半乳糖胺)可以识别并结合细胞表面蛋白去唾液酸蛋白受体(ASGPR),通过内吞将 GalNAc 从细胞表面运送到细胞质。ASGPR 是一种在肝细胞特异性表达的内吞性受体,在其他细胞中几乎不表达,因此在递送范围上存在局限性,仅对于肝靶向有比较好的效果。
GalNAc-siRNA 肝靶向递送技术原理
目前,除对GalNac的专利覆盖较为全面的Alnylam外,近年基于ASGPR/GalNAc递送原理的技术平台层出不穷,包括Dicerna的GalXC、Arrowhead的TRiM、Ionis的LICA等,也构建了与Alnylam的三触GalNAc结构存在显著区别的GalNAc递送系统,并且有部分产品已进入临床II期或III期,未来应用前景可观。
01
企业:Dicerna
递送平台名称:GalXC™
特点:四环结构增强偶联物的稳定性
临床进展:nedosiran用于治疗原发性高草酸尿已向美国FDA提交申请
Dicerna是一家专注于研发试验性RNAi治疗药物的生物医药公司,拥有能够实现肝脏靶向(GalXC™)和肝外靶向(GalXC-Plus™)的递送平台,在2021年该公司被诺和诺德以33亿美元高价收购。
肝脏靶向的GalXC™递送平台可实现RNAi疗法的皮下给药,该平台利用了GalNAc较高的肝脏选择性实现精准递送,并构建了不同于Alnylam的 GalNAc四环结构,可增强偶联物的稳定性,同时还能准确定位多个GalNAc配体,将siRNA成功递送至肝细胞。目前,Dicerna进入临床阶段的产品Nedosiran(DCR-PHXC)、RG6346(DCR-HBVS)和Belcesiran(DCR-A1AT)均利用GalXC™技术开发而成。
采用GalNXc递送体系临床进展最快的小核酸药物是nedosiran,这是唯一一款针对1/2/3型原发性高草酸尿症(PH)开发的RNAi候选药物,2021年8月,Dicerna宣布nedosiran关键临床试验PHYO2的积极top-line结果。已向美国FDA提交上市申请。
02
企业:Arrowhead
递送平台名称:TRiM™
特点:通过优化靶向化合物,实现组织特异性靶向
临床进展:ARO-APOC3用于治疗ASCVD的3期试验预计将于今年结束
Arrowhead是一家旨在开发治疗顽固性疾病的新药物的生物制药公司,成立于1989年。该公司使用广泛的RNA化学组合和有效的递送模式,通过触发RNA干扰机制来诱导靶基因的快速、深度和持久的下调,抑制靶蛋白的产生。
公司在成功开发代表性递送平台TRiM™之前,曾开发两代DPC™递送平台(DPC polymer+targeted siRNA),虽因实验结果不理想而搁浅,但为后续的技术平台开发积累了宝贵的经验。基于过去十多年在靶向药物递送载体上的研发经验,Arrowhead构建了全新的递送平台TRiM™(Targeted RNAi Molecule),该平台去除了有问题的活性内体逃逸剂(PBAVE、MLP),有利于靶向配体与目标受体的直接结合。
该公司基于对RNAi分子形成过程中每一步的深入研究,能够根据需要,针对不同的候选药物可针对性的优化以下组件:高亲和力靶向配体、连接子、稳定的候选RNA药物、增强药代动力学的结构,从而对RNAi疗法的稳定性,药代动力学特性,以及靶向递送能力进行优化。通过改变与RNAi分子偶联的靶向化合物,这一平台能够将RNAi疗法有特异性地递送到不同的组织中,从而提高治疗不同类型疾病的效率。
基于TRiM™平台,Arrowhead已开发了十几款产品,涉及肝脏、肺、肌肉和肿瘤等组织。进展最快的是ARO-APOC3,这是一种特异性抑制APOC3表达的RNAi,旨在特异性沉默肝脏中APOC3 mRNA 的表达,减少循环血液中的APOC3 和TG,从而治疗动脉粥样硬化性心血管疾病(ASCVD),目前正在在进行III期临床研究。
此外,靶向配体为GalNAc的相关产品ARO-HBV(JNJ-3989)、ARO-AAT(TAK-999)和AMG-890(Olpasiran)分别与Janssen Pharmaceuticals、Takeda和Amgen达成合作协议,Arrowhead从交易中获得的潜在价值高达数十亿美元。
03
企业:Alnylam
递送平台名称:ESC+ GalNAC平台
特点:相比ESC减轻脱靶效应和肝毒性
临床进展:ALN-HBV-02、zilebesiran已进入2期临床
Alnylam 是 siRNA领域的龙头企业。一直深耕 RNAi 治疗领域,相继开发了多个递送平台,包括第二代脂质纳米粒子递送平台 (DLin-MC3-DMA)和 GalNac 递送平台,均是RNAi药物递送领域的突破性技术。由于 GalNac 相比 LNP 递送系统具有显著优势,因此除了已获批的 Patisiran 使用了 LNP,目前公司在研产品基本均使用 GalNac 偶联递送系统。为了进一步提高递送效率和安全性,公司也在持续更新迭代GalNac 平台,从 STC 到 ESC 再到 ESC+,不断完善小核酸药物开发技术。
ESC是Alnylam的第二代GalNac 递送平台,通过在反义链的 5'端和正义链的3端包括另外四个PS 键进行化学修饰,增强了药物的稳定性以及肝脏的靶向性,但其缺点是仍有可能在肝脏沉默其它非靶点基因,从而导致肝脏毒性,此现象称为siRNA脱靶效应。siRNA脱靶效应是导致GalNAc-siRNA偶联物肝毒性的主要原因。
为降低脱靶效应,基于ESC技术,Alnylam进一步在种子区域(seed region)用乙二醇核酸(GNA)的 (S)-异构体取代单个核苷酸来破坏配对的稳定性,使种子区域的核苷酸杂乱无章。结果显示,这种修饰可以显著减轻脱靶效应并减轻肝毒性,因为这些修饰以种子区特异性方式影响siRNA与不需要的靶 mRNA 的结合。
目前应用ESC+ GalNAC平台进展最快的药物是zilebesiran (ALN-AGT)、 ALN-HBV02 ,均已进入2期临床。zilebesiran (ALN-AGT)是一种正在开发的用于治疗高血压的研究性RNAi疗法。ALN-HBV02是一种GalNAc-siRNA偶联物,旨在靶向乙型肝炎病毒(HBV),用于治疗慢性乙型和丁型肝炎病毒感染。关于ALN-HBV02安全性和抗病毒活性的研究显示,2次皮下注射VIR-2218治疗后,大多数患者在第12周达到最大HBsAg下降幅度,平均比基线HBsAg水平下降1.5 log10。
递送平台类型2:基于纳米颗粒载体
纳米颗粒是粒径在10-1000nm范围内的颗粒状分散体或固体颗粒。使用纳米颗粒进行递送可获得更高的跨细胞膜运输效率、良好的生物相容性。用作小核酸药物递送载体的纳米颗粒中最常见的是脂质纳米颗粒(Lipid Nano Particle,LNP),这是一种化学合成的多成分脂质体制剂,封装核酸分子递送至靶组织,抵达作用部位前避免被核酸酶降解。
在 Arbutus和 Alnylam 等公司的开发下,LNP递送系统共经历三次迭代,主要代表类型为 DLin-DMA、 DLin-MC3-DMA和 L319。DLin-MC3-DMA开发后,LNP也首次应用在小核酸药物Onpattro®中并获批上市,使得当时LNP成为了最常用的 RNA 递送技术。为避免专利纠纷,三代LNP使用的 LNP 的区别主要在于阳离子脂质上。
Alnylam的Patisiran 的成功上市说明了 LNP 作为小核酸药物载体的可行性。然而可电离阳离子的毒性限制了其最大的给药剂量,并且使用其长期给药引起的副作用仍需要进一步观察。研发具有可降解、低毒性、器官特异性靶向等特质的新型纳米颗粒是未来的研发方向。
01
企业:圣诺医药
平台名称:多肽纳米颗粒(PNP)递送平台
特点:可携带多个siRNA,通过协同效应提升治疗效力
临床进展:双靶点siRNA STP750已进入临床 II 期研究
圣诺制药(Sirnaomics)成立于2007 年,作为国内领先的RNAi公司,产品在中美两地同步研发,已经建立了较为丰富的研发管线,覆盖了肿瘤、纤维化等疾病领域。
公司专有的PNP(peptide nanoparticles)递送平台旨在解决脂质纳米颗粒(LNP)及传统GalNAc RNAi递送平台的瓶颈。PNP 是由人工设计和合成的赖组氨酸多肽共聚物(HKP)构成,HKP是一种可促进siRNA活性成分递送的非活性成分,其包裹在siRNA周围,通过静电和氢键的相互作用缠绕siRNA,自我组装形成PNP。
PNP主要的优势:1)由于多肽及 RNA 的生物可降解性,PNP 具有很高的安全性,并可通过局部或全身给药的方式将siRNA和mRNA递送至除肝脏外众多靶向器官。2)PNP支持同时携带多个不同靶向的siRNA,从而可以同时击倒两个不同的靶基因以产生协同效应,从而提升对抗疾病的治疗潜力。
目前圣诺使用 PNP 作为递送载体的管线遍布肿瘤,纤维化,医学美容等各个方面,其中进展最快的是STP705,这是一种TGF-β1 和 COX-2 的双靶点 siRNA 药物,用于治疗原位鳞状细胞癌,目前已进入临床 II 期研究,并在2022年12月宣布其Ⅱb期临床试验获得积极中期数据。
02
企业:EnGeneIC
平台名称:EDV(EnGeneIC Dream Vector)内源输送载体纳米细胞平台
特点:毒性小,能刺激有效的抗肿瘤免疫反应,
临床进展:TargomiRs已进入临床 II 期研究
EnGeneIC是一家临床生物制药公司,致力于将其专有的细菌衍生的EDV 纳米细胞发展为功能强大的纳米药物、siRNA或miRNA递送平台,旨在直接靶向并有效杀死肿瘤细胞。EDV™技术是利用基因工程改造过的细菌分裂形成的直径为400纳米的纳米细胞。在这些纳米细胞中可以携带抗肿瘤的小分子药物、siRNA或者miRNA。同时,这些纳米细胞表面可以连接靶向肿瘤的抗体,使细胞能够与肿瘤结合,被肿瘤细胞吞噬并且在其内部释放出携带的药物。
由于有效载荷仅在癌细胞内释放,因此通过EDV平台开发的药物比当前癌症的治疗模式更有效,毒性更小。同时,EDV还能够刺激先天免疫和适应性免疫反应,通过传递细胞毒素并结合免疫系统的参与对肿瘤进行双重攻击。EDV为治疗耐药性癌症和刺激有效的抗肿瘤免疫反应提供了一种潜在的新手段。
TargomiRs是通过EDV开发的一种全新的抗癌产品,通过将miR-16包裹在EDV纳米细胞中,并连接EGFR抗体,通过静脉输液给药。TargomiRs主要是包含miR-16模拟物,可以通过与miR-15,miR-16等miRNA家族相互作用,从而下调EGFR信号通路,从而导致癌细胞凋亡。目前,TargomiRs用于治疗复发性恶性胸膜间皮瘤(MPM)已推进至临床II期。
基于抗体偶联药物(ADC)的成功开发,将抗体作为药物递送的手段为药物开发者所关注,加上寡核苷酸领域的科学进展,共同催生了抗体寡核苷酸偶联药物(AOC)的设计与发展,并在肌肉疾病、中枢神经系统疾病以及癌症等领域显示出治疗潜力。目前全球在研的抗体核酸偶联物主要为四家公司,包括Avidity Biosciences、Dyne、Tallc、Denali。
03
企业:Avidity
平台名称:AOC(抗体寡核苷酸偶联药物)平台
特点:结合了抗体的组织选择性,克服了递送障碍,
临床进展:治疗DM1的AOC-1001已进入临床 1/2期研究并公布数据
Avidity Biosciences是一家正在开创抗体寡核苷酸偶联药物(AOC)疗法治疗遗传性肌肉疾病的生物医药公司,总部位于美国加州拉荷亚市。公司是AOC技术的先驱,该抗体结合了单克隆抗体的组织选择性和基于寡核苷酸治疗方法的精确性,从而克服了阻碍寡核苷酸传递的障碍,可用于治疗罕见的肌肉疾病和其他严重疾病。
Avidity的AOC平台基于多年的内部工程构建,整合了寡核苷酸疗法、RNA加工修饰、抗体工程和偶联以及药物递送技术。该AOC平台的灵活性使得公司能够对各种类型的寡核苷酸进行递送,包括小干扰RNA(siRNA)和磷酰二胺吗啉代寡核苷酸(PMO),以不同方式修饰RNA功能,从而为不同疾病定制AOC疗法。
基于专有的AOC平台,Avidity目前建立了专注于骨骼肌领域的产品管线,并希望拓展到其他细胞和组织领域,如免疫细胞和心脏组织等。目前治疗1 型强直性营养不良 (DM1) 的AOC-1001进度最快,去年年底其公布了MARINA™ 试验的初步数据,有史以来首次成功地将 RNA 定向递送到肌肉中,这是 RNA 治疗领域的革命性进步。
聚合物基质通过静电相互作用与核酸结合并凝聚成小而紧密的结构。缩合的过程是由熵驱动的,当阳离子聚合物与核酸混合时,多聚物自发产生。借助聚合物基质保护 RNA结构,可以实现实体瘤内药物递送,核内体逃逸效率高。目前在研企业主要为Silenseed公司。
04
企业:Silenseed
递送平台名称:LODER(LOcal Drug EluteR) 递送平台
特点:允许在肿瘤环境中siRNA缓慢、延长siRNA释放几个月
临床进展:针对KRAS G12D胰腺癌的siG12D-LODER处于临床Ⅱ期
Silenseed成立于1999年,位于以色列。公司凭借其专有的RNAi技术和LODER递送系统,可有效渗入并治疗恶性实体瘤,同时降低全身毒性。
LODER 基质是一种高分子量的聚乳酸共乙醇酸(PLGA)共聚物,其是直径为1nm,高度为 5nm 左右的圆柱体,作为一款 siRNA 递送系统,其能够通过移植肿瘤的方式,使siRNA药物直接到达肿瘤细胞,并且 LODER 还具有缓释能力,在保护siRNA免受环境中的核酸酶降解的同时能够使 siRNA 在肿瘤中缓慢释放达2月。
目前 Silenseed 公司使用LODER 递送系统在研有多款药物,其中核心产品是针对KRAS G12D胰腺癌的siG12D-LODER,目前处于临床Ⅱ期阶段。
小 结
经过近半个世纪的积累,递送技术逐渐成熟,并呈现出平台化的特点,使小核酸药物的开发进入了快速增长期。除了以上谈到的几种递送技术平台,外泌体、脂质纳米晶体(LNC)、脂质多聚复合物(LPP)等其他一些前沿递送技术平台也正在逐渐兴起,并已在临床阶段崭露头角,但还需大量的数据来验证其效力与安全性等。
总而言之,小核酸药物的递送仍面临一些技术挑战。如何进一步提高递送效率、降低递送系统的毒性、实现对其他肝脏外组织和器官的特异性递送是该领域的研究热点。每种递送平台都各有特点,但最终都将回归到临床需求以及技术本质,期待未来更多新型递送平台被开发,助力小核酸治疗释放更大潜力!
资料来源:公司官网、高特佳Insights、医闻道、丰硕创投、医药魔方、科睿唯安、国金证券、广证恒生、财通证券、弗若斯特沙利文
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..