近年来,受新冠大流行的影响,FDA检查经历了多次中断。尽管 2022 财年的大部分时间恢复了正常的国内检查,但 FDA 直到 2022 年 4 月才恢复所有国外检查。本文将从宏观角度分析FDA在2022财年(2021年10月1日至2022年9月30日)发出的药品基于检查的警告信,并对当前趋势和来年预测提供思考。更多关于从微观角度(统计数据和缺陷项)的分析,可参见往期资讯:让数据说话:FDA近年来检查关注点变化、FDA在2022财年发布的警告信和483缺陷项统计梳理。
2022 财年,FDA 共发布了 165 封药品警告信。其中有 74 封是基于现场检查的观察结果,16 封来自测试样品,3封来自联邦食品、药品和化妆品法案(FD&C 法案)第 704(a)(4) 条规定的记录请求。其余的警告信通常是审查产品标签、注册材料和/或网站的结果。
在现场检查的 74 封警告信中,有 7 封来自生物研究监测 (BIMO) 检查,8 封来自人体细胞、组织或细胞产品 (HCTP),两封来自GLP 检查,9 封发给了制药复合公司,1封发给了一家 PET 药品生产商。本文不包括 GLP 检查发出的警告信、发给制药复合公司的警告信和发给 PET 药品生产商的警告信,目的是将分析重点放在现场检查期间观察到的违规行为引发的最相关的 62 封警告信上。
BIMO和HCTPs警告信
FDA 进行 BIMO 检查以评估提交给FDA的数据质量和可靠性,以支持上市申请并保护人类受试者。2022 财年,FDA 观察到研究执行失败和人类受试者入组不当,其中大部分BIMO警告信发给了美国公司。BIMO 7封警告信中的3封提到未能根据调查计划进行调查,FDA 对关于危害受试者安全和数据可靠性的研究计划偏差表示担忧。FDA 还发现缺乏对安全相关测试要求的遵守,未能遵循随机化和研究盲法协议以防止偏倚,以及未能提交 IND 申请以进行新药临床研究。7封信中有两封发现机构审查委员会使用不当,其余两封包括对未能获得参与者知情同意,和未能将文件保留两年的意见。
2022 财年,FDA 向生产 HCTP 的美国公司发出了8封警告信。其中4封提到样本中传染病的评估或测试不充分,表明 FDA 认为这是 HCTP 安全性和可用性的首要考虑因素,尤其是对于以生育为重点的产品。其余4封引用了 21 CFR 1271.3(f)(1),并警告其产品已被加工到改变其原始特性。此类产品不符合 HCTP 的条件,而是需要作为药品或生物制品进行上市前审查和批准。
FDA 还指出8家 HCTP 生产商中有5家未能建立旨在防止微生物污染和验证声称无菌产品工艺的书面程序。FDA将此视为质量体系不成熟的一个指标,并在基于药品检查的警告信中发出了类似的警告。有趣的是,这些 HCTP 警告信并未包括聘请第三方顾问协助 GMP 合规性的建议,而在药品相关的警告信中,多数都建议聘请第三方顾问。
药品警告信
其余 47 封发给药品生产商的基于检查的警告信与过去几年相比,地域多样性有所减少,其中 3 家公司位于印度,2 家位于中国,德国和西班牙各有 1 家,其余 40 封警告信均在美国(包括来自波多黎各的一个)。这并不奇怪,因为 FDA 在 2022 财年的很大一部分时间里进行国外检查的能力有限。
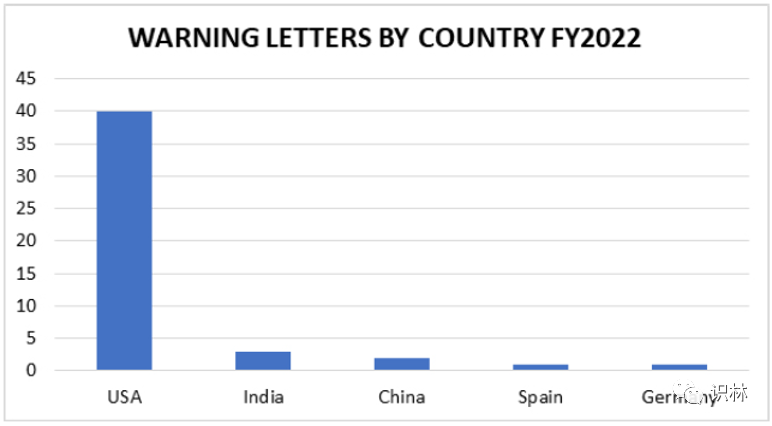
图1. 2022财年各国收到的药品警告信数量
大多数警告信发给了 OTC 生产商(共 32 家),其中包括唯一的顺势疗法产品生产商,以及1家生产 OTC 药品和医疗器械的公司。其余的警告信发给了6家成品处方药生产商和9家 API 生产商。FDA 还指出,3封警告信发给了合同检测实验室(一个合同检测实验室检测 OTC 产品,一个检测 API,一个检测成品药物)。
值得注意的是,有 16 封警告信针对洗手液产品,另有 5 封警告信针对外用美白产品。对洗手液的关注与新冠大流行和 FDA 在确保产品安全的同时扩大洗手液供应的监管工作直接相关。
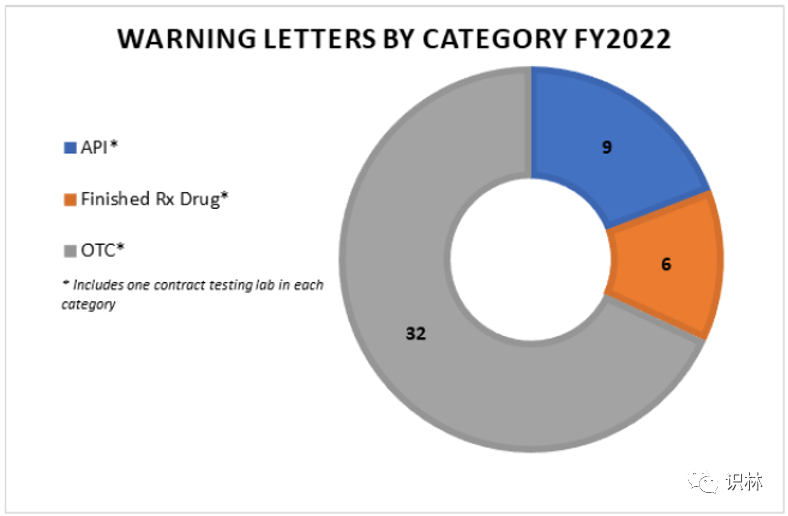
图2. 2022财年药品警告信分类数量
在经过分析的警告信中确定的其他一般趋势也值得强调。例如,大多数警告信 (42封) 都包括建议保留专家顾问以协助公司进行补救工作,这一趋势近年来变得越来越标准。
此外,尽管 2021 年和 2022 年的检查次数远低于非大流行年份,但调查人员及时发函。47 封警告信中只有1封是在检查最后一天后的 12 个月内发出的。其中,最短的周转时间不到4个月,检查于 2021 年 11 月 19 日结束,并于 2022 年 3 月 14 日收到警告信。尽管自 2019 年和 2020 年初以来发生了很大变化,但 FDA 并没有忘记大流行之前的违规行为,47 封警告信中有 19 封特别强调了是重复观察的缺陷项。
主要新兴主题
FDA 在 2022 财年就三个新兴主题发布了警告信。第一个主题是测试产品成分的重要性,13 封警告信包括对公司仅依赖分析报告单(COA),而未执行适当测试以确保产品满足所需的可接受标准。第二个主题是合同生产职责,FDA在 18 封警告信中强调了与合同生产商和测试实验室达成有效质量协议的必要性,并指出合同生产商与其他生产商一样必须遵守 cGMP 和质量要求。第三个主题是不配合FDA检查,FDA向拒绝配合进行设施检查、导致产品被视为掺杂的公司发出了两封警告信。FDA还根据现场检查列举了严重违反 cGMP 的公司。
2023 年及以后的预测
基于分析和研究,可以对FDA 在 2023 年及以后的执法和检查活动进行潜在预测。虽然 新冠大流行将继续影响运作,但 FDA 将在 2023 年转向更典型的情况,对国外企业进行更多监督,并增加基于检查的警告信。FDA 可能会继续关注 OTC 产品,并密切关注不同类型的生产商(包括合同检测实验室和CMO),以防止药品短缺并增强供应链的弹性。FDA对供应链问责制和弹性持续关注,例如《药品供应链安全法》(DSCSA) 下合同检测服务的问题,建议生产商应该意识到他们对整个药品供应链的责任。
此外,FDA 将寻求了解从大流行中吸取的教训,以及如何应用它们向前推进,包括利用现场检查的替代工具。FDA将需要执行 2022 年 12 月颁布的《食品药品综合改革法案》(FDORA) 中与检查相关的规定,而 FDORA 的许多规定都与 FDA 使用替代工具有关。
作者:识林-雪杉
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..