近日,恒瑞医药PD-1抑制剂卡瑞利珠单抗(艾瑞卡®)联合阿帕替尼(艾坦®)(“双艾”组合)获得NMPA批准用于不可切除或转移性肝细胞癌(HCC)患者的一线治疗。这是中国首个获批的用于治疗晚期肝细胞癌的PD-1抑制剂与小分子抗血管生成药物组合。
“双艾”组合本次适应症获批上市,是基于恒瑞医药推进开展的一项国际多中心III期临床研究(SHR-1210-Ⅲ-310研究)。该研究成果已作为突破性摘要(LBA)在2022年欧洲肿瘤内科学会学(ESMO)年会上进行口头报告。
研究主要终点为总生存期(OS)和由盲态独立影像评审委员会(BIRC)基于RECIST v1.1标准评估的无进展生存期(PFS);次要终点包括疾病进展时间(TTP)、客观缓解率(ORR)、疾病控制率(DCR)和缓解持续时间(DoR);安全性;药代动力学和免疫原性分析。
研究结果显示,“双艾”组合对比索拉非尼作为一线治疗可以显著延长晚期肝细胞癌患者的PFS和OS。其中位PFS(mPFS)为5.6个月,中位OS(mOS)为22.1个月,将疾病进展或死亡风险降低 48.0%,患者死亡风险降低38%,使一线晚期肝细胞癌人群取得显著的生存获益。此外,“双艾”联合治疗方案的客观缓解率(ORR)为25.4%、疾病控制率(DCR)为78.3%(基于RECIST 1.1标准),提高了获益患者人群比例,同时也对患者转化治疗具有重要的参考意义。安全性方面,双艾联合治疗整体安全性可控,耐受性良好,暂未发现新的安全信号。
罗氏的Tecentriq(阿替利珠单抗)加Avastin(贝伐珠单抗)联合疗法(“T+A”疗法)无疑PD-1抑制剂与抗血管生成药物组合治疗晚期肝癌的先行者,不过Avastin是抗血管生成单抗药物。
2020年在IMbrave150研究中“T+A”组合对比索拉非尼在先前未接受系统治疗的不可切除性、局部晚期或转移性肝细胞癌患者,结果显示研究达到了共同主要终点:与索拉非尼组相比,“T+A”组合治疗组OS和PFS均显示出统计学意义和临床意义的改善。具体数据为:在主要分析时间点,与索拉非尼组相比,“T+A”组合组OS显著延长(mOS:19.2 vs 13.2个月)、死亡风险降低42%、12个月生存率提高此外,与索拉非尼组相比,“T+A”组合治疗组疾病PFS显著延长(mPFS:6.8个月 vs 4.3个月)、疾病进展或死亡风险降低41%。
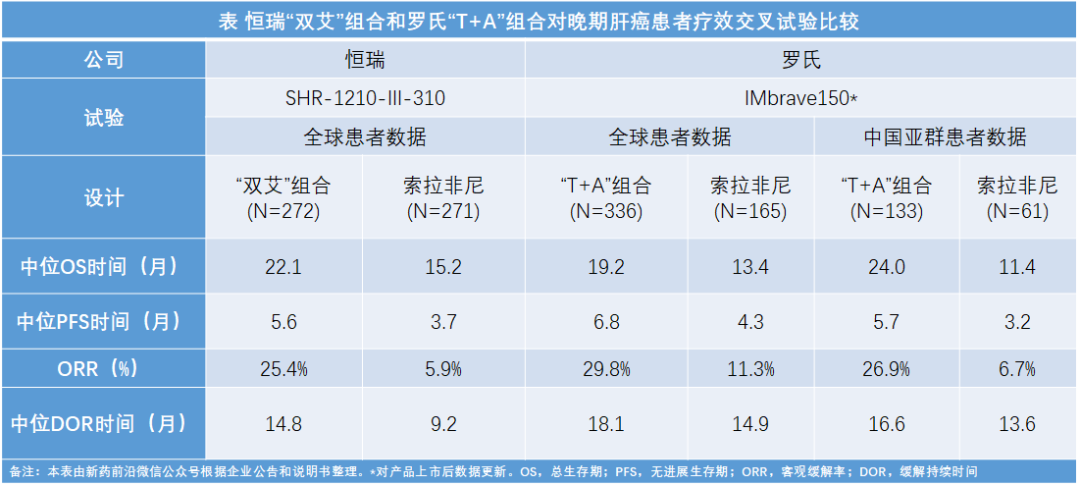
通过对企业上市申请或者产品上市后更新数据进行交叉试验比较,考虑到对照组(索拉非尼)数据,“双艾”组合与罗氏“T+A”组合二者对于全球患者的疗效难分伯仲,未来期待头对头研究直接PK。
从罗氏公布的对中国亚群患者数据来看,“T+A”组合中位OS时间明显高于混合数据(全球患者数据)。
由于中国是肝癌高发的国家,发病和死亡人数约占全球的50%。因此期待恒瑞医药的“双艾”组合未来在公布的中国亚群患者中数据具有更优异表现。
不过目前多款国产/进口PD(L)1单药或者联合疗法在国内获批用于肝癌二线或者一线治疗成为继肺癌之后又一热门大领域。
此外,今年1月19日,罗氏宣布“T+A”组合作为术后辅助治疗,对疾病复发风险高的早期肝细胞癌患者疗效的III期IMbrave050研究中期分析,与主动监测相比,“T+A”疗法在以治愈为目的的切除或消融后复发风险增加的肝癌患者意向治疗人群中,无复发生存期(RFS)方面有统计学意义的改善。
而“双艾”组合针对肝细胞癌根治性手术或消融后伴高复发风险人群辅助治疗的II期研究于去年也在国内开启。
恒瑞医药还在积极推动“双艾”组合走向国际,SHR-1210-Ⅲ-310研究也是恒瑞医药推进开展的首个国际多中心III期临床研究,项目团队已完成与美国食品药品监督管理局(FDA)的多轮沟通,计划在美国递交新药上市申请。此前,卡瑞利珠单抗联合阿帕替尼一线治疗不可切除或转移性肝细胞癌适应症已获得美国FDA孤儿药资格认定。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..