1月27日,礼来宣布,美国食品药品管理局(FDA)加速批准了Jaypirca(pirtobrutinib),用于治疗至少两种系统治疗(包括布鲁顿酪氨酸激酶(BTK)抑制剂)后复发或难治性套细胞淋巴瘤(MCL)的成年患者。
Jaypirca是FDA批准的第一种也是唯一一种非共价(可逆)BTK抑制剂。Jaypirca可以用于先前用共价BTK抑制剂((伊布替尼,acalabrutinib或泽布替尼)治疗的MCL患者。
德克萨斯大学MD安德森癌症中心淋巴瘤和骨髓瘤医学博士、Puddin Clarke Endowed教授Michael Wang说:“Jaypirca的批准对复发或难治性MCL患者来说是一个重要的进步,这些患者目前的选择有限,并且在停用共价BTK抑制剂治疗后预后不良。研究数据表明,Jaypirca可以为以前用共价BTK抑制剂治疗的患者提供疗效,可能延长患者从BTK抑制治疗中获益的时间。”
在Jaypirca之前,FDA已经批准了三种BTK抑制剂艾伯维/强生的Imbruvica(伊布替尼)、阿斯利康的Calquence(acalabrutinib)和百济神州的Brukinsa(泽布替尼)。
但Jaypirca与这些产品不同。
此前批准的三种产品是共价BTK抑制剂,不能连续使用,但Jaypirca是一种非共价的BTK抑制剂。Jaypirca与BTK的结合方式不同,因此可以在另一种BTK抑制剂进展后使用。这种机制为Jaypirca提供了一个独特的机会来治疗另一种BTK抑制剂治疗失败的患者,大多数血液癌症患者最终会在共价BTK治疗后进展。
礼来的肿瘤部门Loxo首席执行官Jake Van Naarden表示:礼来认为Jaypirca治疗当前BTK药物之一失败后患者的“真正机会”。随着时间的推移,医生可能希望在一线使用这种药物。这不是药物的核心价值主张。
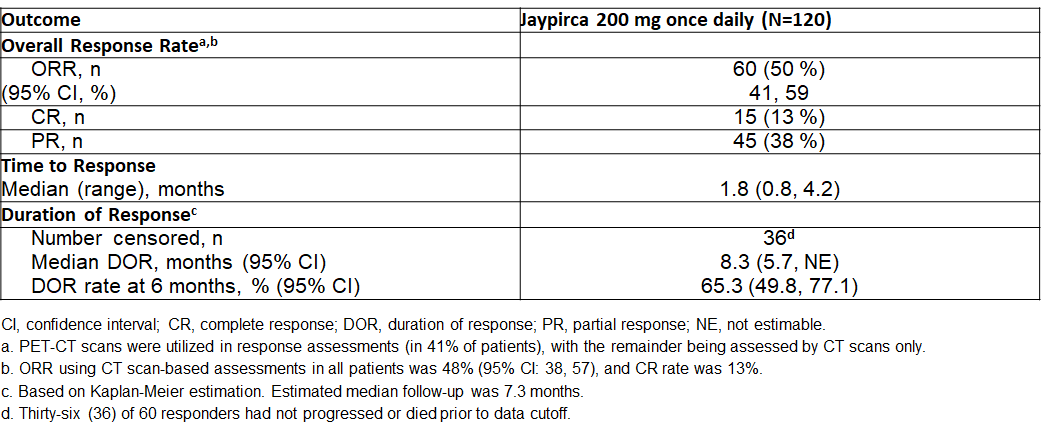
Jaypirca根据1/2期BRIN试验的总缓解率(ORR)和缓解持续时间(DOR)获得了FDA的批准。在一组共价BTK预处理的MCL患者中,Jaypirca(每天一次,每次200mg)的总缓解率为50%,13%的患者完全缓解,反应持续中位时间8.3个月。
据礼来表示,正在进行的3期阶段BRAIN MCL-321试验是一项验证性研究。该试验将Jaypirca与研究者选择的Imbruvica、Calquete或Brukinsa进行了比较。
虽然所有四种获得FDA批准的BTK抑制剂都在MCL中获得了初步批准,但慢性淋巴细胞白血病(CLL)对该药物类别的产品来说更为重要。
Jaypirca已经有了一些数据。根据2022年ASH上的数据,在同一1/2期BRIN试验中,Jaypirca在一组82.2%的BTK预处理CLL患者中缩小了肿瘤。
礼来正在与FDA讨论CLL数据,但尚未准备好对任何潜在的监管计划发表评论。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..