在2022年10月欧洲药品管理局(EMA)人用药品委员会(CHMP)的会议上,Atara Biotherapeutics的Ebvallo(tabelecleucel)获得了该机构积极推荐批准意见。
Ebvallo用于治疗爱泼斯坦-巴尔病毒(EBV)阳性的移植后淋巴增生性疾病。这种获得EMA先进治疗药物资格(ATMP)的药物适用于实体器官移植或骨髓移植后出现严重并发症的成人和儿童患者。Ebvallo通过EMA的优先药品资格(PRIME)计划获得支持,该计划为那些在解决患者未满足的医疗需求方面具有特殊潜力的药品提供早期和强化的科学和监管支持。
如果获得批准,Ebvallo将有望成为世界上第一个批准的异基因T细胞疗法。异基因T细胞疗法是由不相关的供体细胞预先制造的。与目前的自体T细胞疗法不同,例如百时美施贵宝的Abecma和Breyanzi以及吉利德的Yescarta和Tecartus,这些产品都是从患者自身的免疫细胞中提取的。
根据CHMP的积极意见,预计在特殊情况下,欧盟委员会(EC)将于2022年底批准Ebvallo营销授权申请(MAA)。如果得到欧盟委员会的批准,集中营销授权将在所有欧盟成员国以及冰岛、列支敦士登和挪威有效。此外,MAA将根据EC决策依赖程序(EC DRP)提交给英国药品和保健品管理局(MHRA),预计将在2022年底获得批准。
根据现有合作协议,皮埃尔·法布雷(Pierre Fabre)将领导欧洲的所有商业化和分销活动,并在欧洲获得预期的MAA批准后,选择除医疗和监管活动之外的其他市场。
根据最近与法国Pierre Fabre公司达成的商业化协议,Atara将在欧洲批准后获得3000万美元的里程碑式付款。
今年8月,Atara总裁兼首席执行官Pascal Touchon还表示:FDA建议了一条无需进行新临床研究就可以提交tabelecleucel 生物制品上市许可(BLA)的潜在途径。
Atara这家总部位于旧金山的公司在努力推进其T细胞治疗的艰难一年后,即将获得的批准将成为该公司里程碑式的成就。
Atara公司是同种异体T细胞免疫疗法领域的先行者,拥有行业领先的同种异体细胞制造工艺和下一代CAR-T技术。
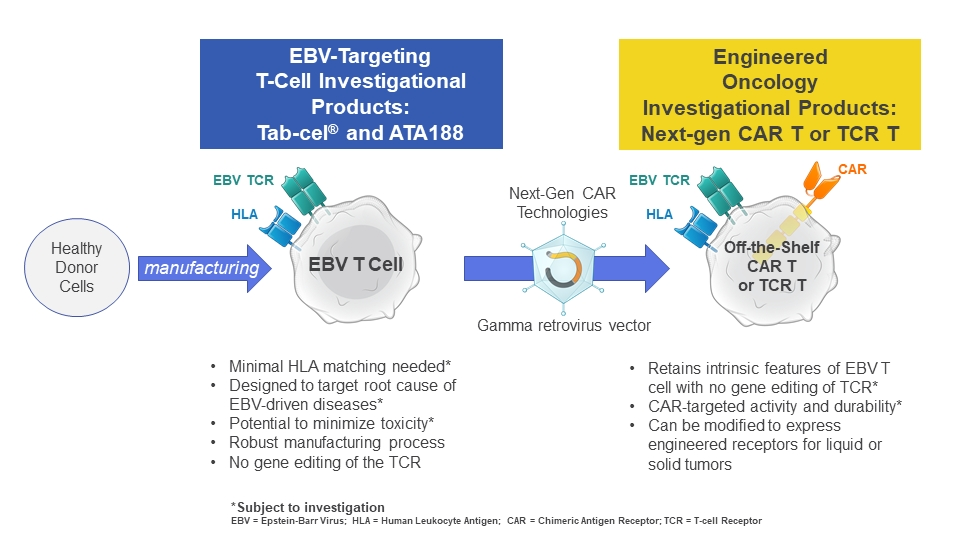
2020年12月,拜耳与Atara达成一项独家全球许可协议(最高合作金额6.7亿美元),共同开发用于治疗实体瘤的下一代间皮素导向CAR-T细胞疗法。该协议包括开发候选药物ATA3271(一种增强型下一代同种异体T细胞免疫疗法)以及自体版本的ATA2271,用于治疗存在间皮素高表达的肿瘤,例如恶性胸膜间皮瘤以及非小细胞肺癌。今年初在Atara的ATA3271试验中一名患者死亡后,该研究的注册被终止,商业合作伙伴拜耳退出了这项合作关系。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..