日前,葛兰素史克(GSK)和Spero Therapeutics宣布,已就Spero正在开发的晚期抗生素Tebipenem HBr (氢溴酸泰比培南酯)达成独家许可协议。Tebipenem HBr作为第一种口服碳青霉烯类抗生素,可治疗由某些细菌引起的复杂性尿路感染(cUTI),包括肾盂肾炎。
根据许可协议的条款,葛兰素史克将向Spero支付6600万美元的预付款,以确保获得该药物的权利。葛兰素史克与Spero还达成股票购买协议,葛兰素史克已同意对Spero普通股进行900万美元的投资。
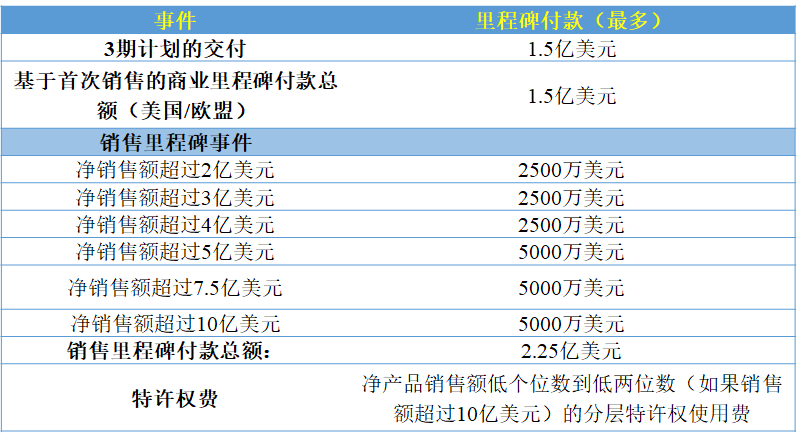
此外,葛兰素史克对该项目其他的潜在付款是基于里程碑,如下所示:
该笔交易有望使今年6月被FDA拒绝的Tebipenem HBr起死回生!
Tebipenem HBr(氢溴酸泰比培南酯;原代码SPR994)是Spero的新型晚期开发项目,是泰比培南酯的口服制剂,一种β-内酰胺类碳青霉烯类抗生素,由合作伙伴Meiji Seika Pharma自2009年起以Orapenem商品名来在日本上市销售,用于治疗仅限于肺炎、中耳炎和鼻窦炎的儿科感染。Tebipenem HBr正在开发用于治疗cUTI,包括由某些细菌引起的急性肾盂肾炎。如果获得批准,Tebipenem HBr将成为第一个在美国获得上市批准的口服碳青霉烯类抗菌药物。
Tebipenem HBr已被美国FDA授予用于cUTI和急性肾盂肾炎治疗的合格传染病产品(QIDP)和快速通道指定。
2021年10月28日,Spero向FDA提交用于治疗包括肾盂肾炎在内的复杂尿路感染的Tebipenem HBr的新药申请(NDA)。
今年6月,Spero收到FDA的一份完整回复信(CRL)。在CRL中,FDA表示已完成对NDA的审查,并确定NDA不能以目前的形式获得批准,需要进行额外的临床研究。
Spero随后立即要求与FDA举行A类会议,以进一步了解潜在的监管批准Tebipenem HBr的途径。根据近期美国FDA在Spero的A型会议上的反馈,Spero仍需将进行额外的3期试验以支持监管提交。
葛兰素史克与Spero的交易赋予前者获得了Tebipenem HBr除日本和某些其他亚洲地区以外的权利(这些国家将由Spero合作伙伴Meiji Seika Pharma保留),并使Spero能够在明年开始FDA要求的新的3期试验。
有意思的是:葛兰素史克将向Spero支付预付款6600万美元,是交易消息传出前Spero公司2900万美元市值的两倍多,这引发了葛兰素史克为什么不直接收购该公司的问题。交易信息(9月22日)披露当天,Spero股价飙涨167.64%。
葛兰素史克承诺在里程碑式投资中达到5.25亿美元。GSK已将1.5亿美元的里程碑与3期试验的交付挂钩,并为项目的首次销售提供了1.5亿美元。如果销售额超过一系列门槛,将会触发剩余的2.25亿美元。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..