近两年,致力于阻断和预防免疫介导性疾病的生物制药公司Provention bio频频出现在大众视野中,极具噱头。
尽管其核心产品PRV-031在提交FDA申请后因其未能证明具有PK(PK是证明两种产品间具有可比性的主要终点指标)可比性而未通过生物许可申请(BLA)审查,但作为第一个针对1型糖尿病(T1D)的免疫调节器,每一期临床试验都引起股价的变动。2019年6月,Provention bio在美国糖尿病年会上宣布PRV-031试验结果到达临床终点,当天股价上涨了300%。
现如今,经过几轮股份增发,截至今年9月,Provention bio市值已经达到4.11亿美元(约合人民币29亿)。
今年九月,Provention bio宣布从Hercules Capital获得了1.25亿美元定期贷款融资,该轮融资第二期发放时间为公司重点产品PRV-031获得FDA批准上市后。1月,Provention bio重新提交FDA申请,FDA接受申请并已将用户费用目标日期从2022年8月17日延长至2022年11月17日。
从接受A轮投资到IPO几轮增发,Provention bio围绕免疫介导性疾病药物研究与各大机构展开合作,尽管还未有药物获得FDA批准,但其发展道路已然明晰。那么,Provention bio是如何赢取各大合作伙伴的青睐的呢?
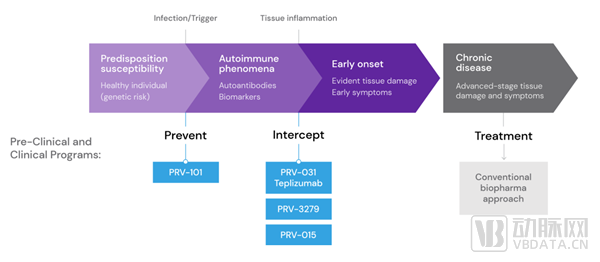
Provention bio创立于2016年10月,其总部位于美国新泽西州,是一家专注于阻断和预防免疫介导性疾病的临床生物制药公司,2018年7月在纳斯达克上市。Provention bio的重点产品是PRV-031(teplizumab),前期由礼来(Eli Lilly)共同研发,这是一种用于干预、延缓1型糖尿病的Anti-CD3单克隆抗体药物。除此之外,Provention bio还有多种针对1型糖尿病、红斑狼疮、乳糜泻等自身免疫型疾病的候选临床药物。
Provention bio的联合创始人之一、首席执行官(CEO)Ashleigh Palmer,获得布拉德福德MBA学位和曼彻斯特大学生物化学和应用分子生物学荣誉学士学位。他在生物制药领域拥有超过30年的经验,曾在iNO Therapeutics担任首席执行官时开发并商业化了INOmax®,这是世界上第一个选择性肺血管扩张剂。
Provention bio的另一个联合创始人、首席科学官(CSO)Francisco Leon,毕业于马德里自治大学,获得粘膜免疫学博士学位,拥有超过20年的学术研究和生物制药经验,研究开发共5种药品上市。
1型糖尿病能否预防?
1型糖尿病(T1D)是一种影响健康的慢性疾病,由胰腺中产生胰岛素的细胞的免疫破坏引起。直到今天,没有治愈的方法。管理这种疾病的唯一方法是终身血糖监测和注射胰岛素。为预防这种疾病,Provention bio开始了多项候选药物的临床研究。
候补药物作用机制 来源:Provention bio官网
■ PRV-101
一项研究表明,柯萨奇病毒B(CVB)感染可能是触发T1D的影响因素,T1D的发作通常表现在感染CVB之后。CVB是一种常见的、潜在的严重感染,会损害产生胰岛素的细胞和肠道内膜细胞,引发T细胞免疫反应,而该反应会导致易感免疫型疾病。因此,如果能够实现阻断CVB病毒的感染,对高风险人群接种CVB疫苗就有可能预防或延缓T1D的发病。
CVB疫苗最初由芬兰生物技术公司Vactech有限公司开发,并于2017年4月获得认证许可。2017年7月,Provention bio获得Vactech的CVB疫苗平台许可,在JDRF T1D基金的投资支持下来推进PRV-101(萨科齐B型疫苗)的研究。
2018年,Provention bio与荷兰生物技术公司Intravacc成为合作伙伴。2020年启动了PRV-101首次人体临床试验,如果成功,PRV-101将成为第一支预防CVB的疫苗,并可能降低T1D和乳糜泻的发病率。
今年3月,PRV-101的临床试验结果发布。在最后一剂疫苗后6个月,PRV-101达到了主要终点,确认了先前报告的中期分析中观察到的耐受性,没有严重不良事件、特殊不良事件或导致研究药物停药的不良事件。结果还显示了病毒中和抗体(VNT)反应的耐久性。在最终给药后6个月的时间点,高剂量PRV-101组中保持高滴度VNT的受试者的百分比对疫苗中包含的大多数血清型为100%,对所有血清型不低于90%。
■ PRV-031
2018年5月,Provention bio宣布与MacroGenics达成协议,获得一款用于干预、延缓1型糖尿病的Anti-CD3单克隆抗体药物PRV-031(Teplizumab)。该药物之前由MacroGenics和礼来合作研发。
2019年4月,Provention bio宣布开启PRV-031的三期临床试验。这次试验,总共招募300名1型糖尿病患者。目的是为了验证PRV-031在儿童和8-17岁青少年1型糖尿病患者中减缓β细胞的作用,这个为期18个月的试验结果将会在2023年上半年公布数据。
2019年6月,由美国国立卫生研究院(NIH)赞助的“高风险(At risk)”研究对PRV-031进行了评估。研究招募了76名8-49岁处于“高风险”中的1型糖尿病患者,其“高风险”是由于他们患有两个或两个以上的T1D自身抗体和异常的葡萄糖代谢(高血糖症);72%的参与者年龄在18岁以下,受试者被随机分配接受PRV-031(替普珠单抗)或安慰剂。
评估结果表明,与安慰剂相比,单次14天疗程的PRV-031(替普珠单抗)在被认为处于高风险的儿童和成人中,临床T1D的发病和诊断显著延迟了2年。试验期间,安慰剂组中72%的人患上了临床糖尿病,而PRV-031(替普立单抗)组只有43%。研究中大约60%的受试者在仅接受一个疗程的PRV-031治疗后没有发展T1D,这是安慰剂组的两倍,也就是说,其发病率降低了50%。
这项研究结果表明,PRV-031成为了第一个显示1型糖尿病临床发病延迟的免疫调节剂,有望干预并从根本上改变高危群体T1D进展。
因为这项研究,PRV-031被FDA授予突破性治疗(BTD)称号,同时被欧洲药品管理局(EMA)授予PRIORITY MEDICINES(PRIME)指定——为其提供特殊支持,包括加强互动和对话,以及加速评估和审查的途径。
2020年,Provention bio在美国糖尿病协会(ADA)科学会议上宣布 ,由T1D研究人员网络TrialNet的研究结果表明,与安慰剂相比,PRV-031(特普利珠单抗)的14天疗程显著延缓了患者1型糖尿病(T1D)的发病,中位数约为三年,比之前“高风险”研究结果增加了一年。另外发现,PRV-031显著逆转了C肽水平的下降——C肽水平的下降,更容易引发糖尿病——这表明PRV-031更能够维持C肽水平的稳定。
有了这些显著的试验结果,2021年初,Provention bio就向FDA提交了PRV-031生物制剂许可证申请(BLA)。FDA以PRV-031没有能证明PK可比性为由拒绝此次申请。此前在对PRV-031的资格审查中,FDA还召开了一次咨询委员会会议,会议中就“PRV-031的益处大于支持批准延迟临床1型糖尿病的风险”一问进行投票,获得10(支持):7(反对)的票型。
今年2月,Provention bio重新向FDA提交了BLA申请;3月,FDA已接受重新申请,并将用户费用目标日期延长至2022年11月17日。
这一项药物的BLA申请关系着Provention bio能否获得Hercules Capital的二期融资,同时也关系着T1D药物是否取得新突破。
其他免疫介导型候选药物
■ 红斑狼疮(PRV-3279)
红斑狼疮是一种(SLE)是一种可引起全身炎症和疼痛的慢性自身免疫性疾病。SLE患者可能会经受关节疼痛、皮肤过敏、皮疹以及内脏器官(脑、肺、肾和心脏)问题。目前没有可以治愈红斑狼疮的药物,其治疗的目标是缓解症状、减少器官损伤。
PRV-3279是由MacroGenics开发的一种针对B细胞膜蛋白CD32B和CD79B的研究性人源化双特异性DART分子,2018年与MacroGenics达成合作协议继续开发。2019年,Provention bio启动了一项随机、双盲、安慰剂对照的1b / 2a期临床研究,该试验在美国和中国香港进行,将评估PRV-3279对减少SLE发作的效果。
2021年,Provention bio与华东医药股份有限公司全资子公司杭州中美华东制药有限公司宣布达成战略合作,中美华东制药有限公司将获得PRV-3279未来在大中华区开发和商业化的权益。
■ 乳糜泻(PRV-015)
乳糜泻是一种慢性遗传性全身性免疫介导性和炎症性疾病,会导致小肠内壁受损,引起胃肠道功能障碍和其他并发症。
PRV-015,也称为AMG 714,是一种与IL-15结合的人免疫球蛋白单克隆抗体。2018年,PRV-015已进行两项临床试验。现在,Provention bio正在招募患者参与2期临床试验,计划招募18-70岁确诊的乳糜泻患者参加为期32周的试验,其目标是为了测试PRV-015的安全性和效果。预计到2023年底,这项研究将获得结果。
■ 克罗恩病(PRV-6527)
克罗恩病是原因不明的肠道炎症性疾病,在胃肠道的任何部位均可发生,但多发于末端回肠和右半结肠。该病和慢性非特异性溃疡性结肠炎两者统称为炎症性肠病(IBD)。克罗恩病尚无根治的一般方法,若出现并发症时,需要手术治疗。
PRV-6527由杨森制药公司开发,迄今已在178名受试者中进行了临床试验。它是一种高效且选择性的小分子CSF-1R口服抑制剂,Provention Bio正在开发该抑制剂,目标是在克罗恩病成为慢性、改变生活的疾病之前阻止克罗恩病的进展。
PRV-6527目前正在进行随机、双盲、安慰剂对照的2a期,该研究于2018年第一季度启动。
■ 溃疡性结肠炎(PRV-300)
疡病是一种IBD(炎症肠病),会在消化道中引起持久的炎症和溃疡。它影响结肠的最内层,症状随着时间的推移而发生,而不是突然发作。虽然目前的溃疡性结肠炎治疗方法可以减轻症状并带来一部分患者的长期缓解,但无法治愈。大多数患者经历衰弱后再复发,有可能危及生命。
PRV-300也由杨森制药公司开发,是一种同类首创的全人源IgG4κ单克隆抗体(mAb),可结合Toll样受体3(TLR3)的细胞外结构域,具有高特异性和亲和力。
PRV-300目前正在进行一项随机、双盲、安慰剂对照的1b期临床试验 - PULSE(Provention UL认证性Colitis Study E估值)研究,该研究于2018年第一季度启动。
据公司财报显示,截至 2022年6月30日,公司在 2021 年ATM计划下拥有 1.356 亿美元的可用容量。Provention Bio在2022年第二季度结束时获得了9610万美元的现金,同时由与杭州中美华东医药公司的合作中确认了700万美元的收入。
尽管PRE-031的BLA审查再次被延长了三个月,但最新获得的贷款融资仍然让Provention Bio有能力看到潜在的商业价值。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..