前言:创新药,随着国内每年新注册申报IND/NDA品种的激增,注册工作量同步递增的同时,核查工作也随之递增。对于核查工作,可进一步的划分为药学、药理毒理、临床;药学,是一个品种开展各项工作的根基,故药学核查工作也是业界最为关注的核查内容之一。药学的现场核查,最为重点的两项工作分别为研制现场核查、以及生产现场核查;基于笔者长期以来关注的创新药研发开发内容,故结合指南和自身的工作经验,对注册研制现场核查进行重点内容汇总和总结,以期对各位同仁有所帮助。
1 什么是研制现场核查?
新药,从实验室走向市场,在符合科研逻辑和科研规律的同时,也需要监管部门持续的对关键节点进行管控;由此,就分别对应着注册相关的研制现场核查,以及生产现场核查。
所谓的研制现场核查,是指通过对药品研制合规性、数据可靠性进行检查,对药品注册申请的研制情况进行核实,对原始记录和数据进行审查,确认申报资料真实性、一致性的过程。
PS:研制现场核查包括药学研制现场核查、药理毒理学研究现场核查和药物临床试验现场核查等。具体如下。
表1.1 研制现场类别及主要内容
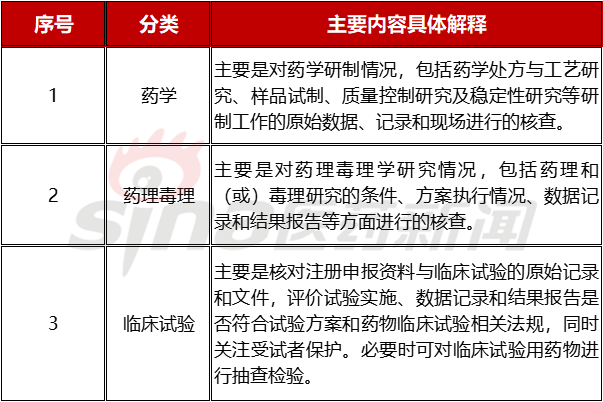
2 药学研制现场核查内容
基于上述,根据《药品注册核查要点与判定原则(药学研制和生产现场)(试行)》,药学研制现场核查(以下简称研制现场核查)的目的主要是通过对药学研制情况(包括处方与工艺研究、样品试制、质量控制研究、稳定性研究等)的原始资料进行数据可靠性的核实和/或实地确证,核实相关申报资料的真实性、一致性。
一般情况下,研制现场核查以确证性临床试验、生物等效性研究等药物临床试验相关批次为起点,直至商业规模生产工艺验证批次前为止,重点包括确证性临床试验批次/生物等效性研究批次等药物临床试验批次、技术转移批次、申报资料所涉及的稳定性试验批次等影响药品质量评价的关键批次。必要时,可前溯至研究立项、处方筛选、工艺优化等研究内容。
基于注册需要和风险原则,研制现场核查可仅针对承担主要研究任务的关键场地进行,也可仅对部分要点的部分内容进行核查。
表2.1 药学研制现场核查要点

3 核查的程序
核查中心在接收到药审中心提出的核查要求后,会按照早已成熟的核查程序进行核查工作的开展。对于药学研制现场核查工作,通常会依照《药品注册核查工作程序(试行)》的逻辑开展工作,依次为任务接收、计划制定、核查实施、报告撰写、报告审核、结果处置,等。具体如下。
表3.1 研制现场核查程序

4 药学研制现场核查认定标准
对研究过程中原始记录、数据进行核实和/或实地确认,未发现申报资料真实性问题,且发现的问题不构成“不通过”情形的,核查认定为“通过”。
其中,对发现申报资料的部分非关键信息不一致或虽然发现数据可靠性问题但可能不影响对药品安全性、有效性、质量可控性评价的,需审评重点关注。
PS:经核查确认发现以下情形之一的,核查认定为“不通过”。
表4.1 核查认定为“不通过”的具体问题

5 小结
综上,即为新药现场核查有关药学方面研制现场核查的重点内容概括。基于笔者自身从事的项目研究开发工作经验,大多数企业对于药学方面研制现场核查,通过率还是较高的,甚至很多工作做的是绰绰有余,这对于核查来说,肯定是能够得到表扬的。但,由于新药研发的阶段性特征,哪些工作需要做,做到什么程度,需要多少的人力物力投入,更是一个企业、乃至制药业应该持续讨论的内容。风险获益比、投入产出比,对于今天的新药研发,已经是避不开的话题,企业要做到的是更为科学合理的进行质量控制,而不仅仅是针对某时某地某次的核查工作;企业也正是基于一个合理性质量控制体系的存在,才能真正的保证药物的质量可靠。
参考文献:
1.《药品注册管理办法》
2.《药品生产监督管理办法》
3.《药品注册核查工作程序(试行)》
4.药品注册核查要点与判定原则(药学研制和生产现场)(试行)
5.药品注册生产现场核查和上市前药品生产质量管理规范检查衔接工作程序(试行)
6.https://www.cfdi.org.cn/cfdi
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..