6月30日,赛诺菲宣布美国FDA部分暂停了其重磅药物tolebrutinib针对多发性硬化和重症肌无力的III期研究,美国地区的患者招募将暂停,入组时间少于60天的患者将停止给药。已经完成治疗60天以上的患者将继续给药。

FDA此决定主要因为此前在III期研究中发现了数例被确认为tolebrutinib治疗相关的肝损伤病例不过反应肝功能的实验室指标异常升高在终止给药后均可逆转。赛诺菲就这些不良事件在更早时间已经与FDA有过沟通,并于5月份修改了部分试验方案,包括更新了监测频次,修改了入组标准,以事先排除存在肝功能障碍风险因素的患者。
在美国以外的国家,tolebrutinib的临床研究将按修订后的方案继续进行,并加强了安全监测。赛诺菲也与独立的数据监测委员会和世界各地的研究人员密切合作,以评估所采取的安全措施的有效性。tolebrutinib的III期项目在2019年启动,目前已经入组并治疗了超过2000例的患者,治疗时间最长的达到3年。
尽管FDA做出了部分暂停的决定,但赛诺菲依然对tolebrutinib保有信心,认为其将是多发性硬化患者的革命性口服疗法。
Tolebrutinib是一款具有高透脑活性的口服BTK抑制剂,能够达到靶向B淋巴细胞和小胶质细胞所需的CSF浓度。2021年4月23日,赛诺菲公布tolebrutinib治疗复发型多发性硬化的IIb期研究数据,显示tolebrutinib在减少患者脑部病灶数量方面呈现剂量依赖性,60mg治疗组较安慰剂组患者可使MS疾病活跃度降低85%,到达主要终点。
2021年9月,Tolebrutinib的最新IIb期研究结果发表在《柳叶刀-神经病学》上,数据显示tolebrutinib可使MS患者新发钆增强病变数量呈剂量依赖性减少,其中60mg剂量组疗效最优,同时药物的总体安全性良好。
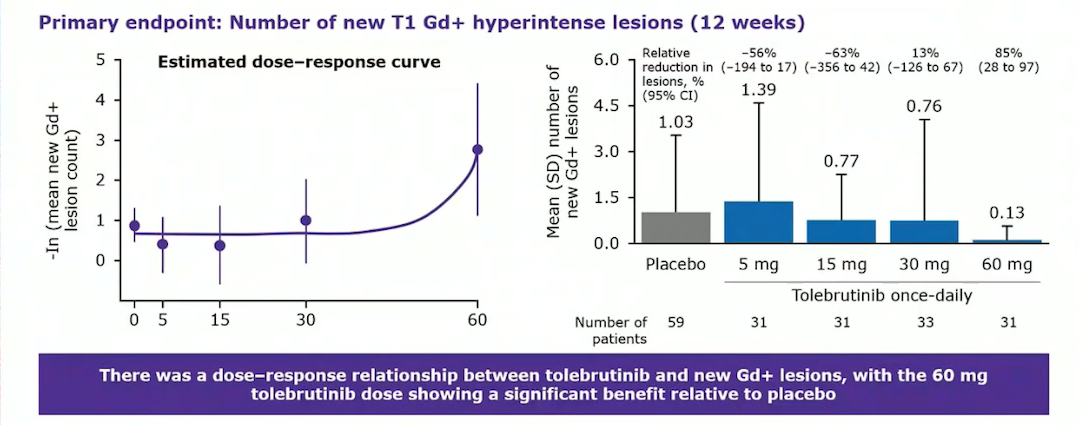
Tolebrutinib是首个完成BTK抑制剂治疗MS概念性验证研究的药物,率先进入III期阶段,目前正在开展针对复发性多发性硬化(RMS)、非复发性继发进展型MS(nrSPMS)、原发性进展型MS(PPMS)和重症肌无力(MG)的III期临床试验。
赛诺菲是BTK抑制剂市场的后来者,但是开辟了BTK抑制剂临床开发的诸多新方向。与其他竞争对手扎堆血液肿瘤不同,赛诺菲瞄准了多发性硬化等相对小众但市场需求巨大的免疫疾病领域。除了自研的Tolebrutinib之外,还在2020年8月与Principia Biopharma达成36.8亿美元的收购交易,获得后者的BTK抑制剂Rilzabrutinib,用于开发治疗天胞疮、免疫性血小板减少症。
不过2021年9月,Rilzabrutinib开展的全球首个BTK抑制剂对比安慰剂治疗中重度天胞疮的III期试验(PEGASUS研究)宣告失败,未达到其主要终点和关键次要终点。
BTK抑制剂在其他厂家手里也有一些创新性的临床开发方向,比如恒瑞医药是全球唯一一家将其BTK抑制剂开发用于治疗原发性膜性肾病的企业。诺华则另辟蹊径,启动了remibrutinib治疗慢性自发性荨麻疹的III期临床研究。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..