近日,美国FDA更新页面“即将发布的复杂仿制药研发特定产品指南”。
该页面展示了FDA计划发布的新增或修订的复杂仿制药特定产品指南(product-specific guidance,PSG),体现FDA目前对特定参考上市药物的仿制药产品开发的想法和期望,帮助仿制药企业确定最合适的方法,提供最有效的证据,以推动特定仿制药的审批。
5月19日FDA也刚发布的BE指南新增24篇,修订14篇。上一次较大的BE指南发布是在2月18日,见识林资讯【FDA发布43篇BE指南,新增诺西那生钠指南】。
识林企业用户可至“BE指南数据库”查阅FDA、EMA、WHO、CDE的全部BE指南。
回顾FDA对复杂仿制药的界定
根据GDUFA II承诺函,复杂仿制药通常包括以下几种:
复杂的活性成分(例如:肽、聚合物、活性药物成分的复杂混合物、天然来源成分)
复杂制剂(例如:脂质体、胶体)
复杂的给药途径(例如:配制成混悬液、乳剂或凝胶剂的局部作用药物,如皮肤病用药、复杂的眼科产品以及耳用剂型)
复杂剂型(例如:透皮、定量吸入制剂、缓释注射剂)
复杂的药械组合产品(例如:自动注射器、定量吸入器)等
其他可受益于早期科学参与、存在批准途径或替代方法的复杂性或不确定性的产品。
关于复杂仿制药,详见识林资讯【如何加快复杂仿制药批准?业界提出改进建议】
修订有三种类型
FDA会在每季度根据需要更新计划发布的新增和修订的PSG。
计划修订类别定义如下:
主要修订(Major revision):包括建议额外的生物等效性研究或证据要求,以支持FDA批准。
次要修订(Minor revision):除主要修订之外的其它修订,包括但不限于移除某些研究,为当前推荐的研究提供替代(简化)方法,添加有关新批准的RLD研究规格的信息,或提出其它建议,这些建议通常不会导致ANDA申请人开展额外的生物等效性研究或证据要求。
编辑性修订(Editorial revision):包括非实质性变更,例如更新外部参考,更正语法问题以及简化现有的格式。
次要修订是当前清单中最普遍的修订,计划修订清单的104份复杂仿制药PSG中有98份将会进行次要修订,另有80份将会进行编辑性修订,仅计划对3份PSG进行主要修订。
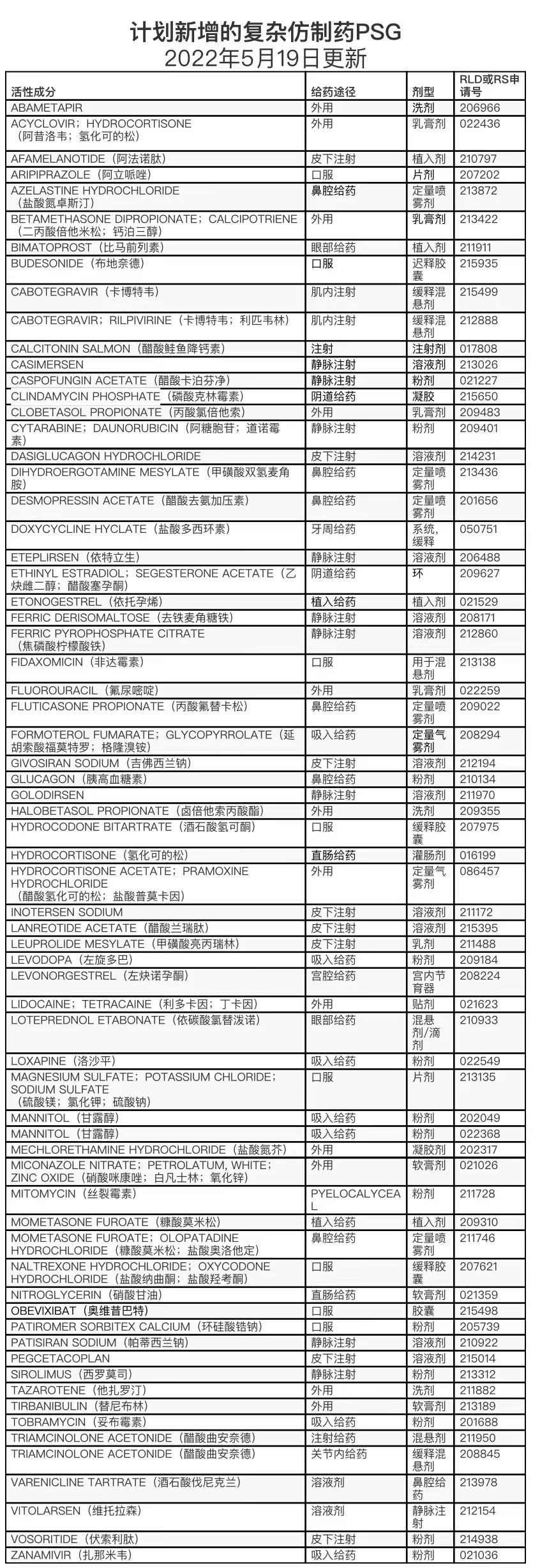
计划新增&修订的复杂仿制药
*篇幅所限,仅提供“计划新增”表格,包含“计划修订”的完整翻译表格请登录识林查阅。此外,部分药品尚未检索到官方中文通用名。
参考资料
https://www.fda.gov/drugs/guidances-drugs/product-specific-guidances-generic-drug-development
https://www.accessdata.fda.gov/scripts/cder/psg/index.cfm
作者:识林-晓林
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..