癌症是最受关注的疾病领域之一。从疾病负担角度看,癌症每年造成近1000万例死亡,占全球死亡总数的近六分之一,有着巨大的未竟医疗需求。而从每年的新药获批角度看,在过去五年里,FDA批准的创新疗法中,数量最多的也是治疗癌症的药物,占每年获批新药的近三成。在今天的这篇文章里,药明康德内容团队将结合今年1-4月的新药获批、监管更新、以及临床进展,为各位读者送上最新的抗癌药物研发动态。
内容概要
共有5款全新抗癌疗法首次获批
共有4款创新抗癌疗法获FDA突破性疗法资格,其中3款尚未获批
共有7款创新抗癌疗法获FDA优先审评资格,其中2款尚未获批
共有17款抗癌疗法在统计区间内获得积极3期临床试验结果,或递交上市申请
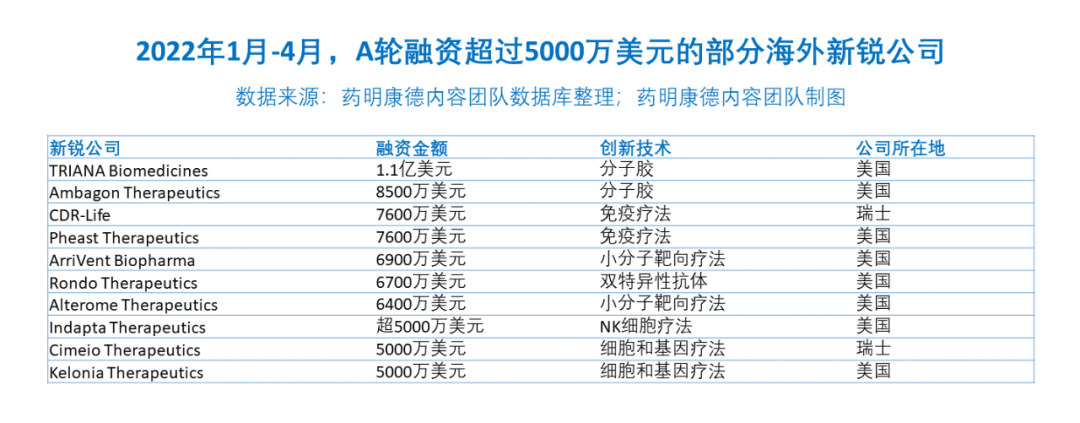
海外共有10家抗癌新锐公司获得5000万美元及以上的融资
取得进展的研发新闻中,最常见的靶点依然为PD-1,其次为HER2
取得进展的研发新闻中,小分子药物、单克隆抗体、抗体偶联药物相关的新闻数并列第一
A轮融资不低于5000万美元的海外新锐公司中,有30%关注创新细胞与基因疗法,20%关注分子胶蛋白降解疗法,20%关注新型免疫疗法
注:统计区间为2022年1月-4月
✦
获批新药
✦
今年一到四月间,美国FDA一共批准了十二款新药,其中四款用于癌症治疗,占比三分之一,与历史数据接近。这四款新药中不乏亮点,包含了首款获批的TCR疗法和首款获批的LAG-3抗体。同期,中国NMPA也批准了多款创新抗癌疗法,其中来自复宏汉霖的抗PD-1单抗尚未在全球其它国家和地区获批。
Kimmtrak(tebentafusp-tebn)
Immunocore
Kimmtrak在今年一月获批,治疗特定的葡萄膜黑色素瘤。作为一款创新的双特异性蛋白,Kimmtrak由两部分融合而成:一端是具有高亲和力的可溶性T细胞受体,另一端是抗CD3的免疫效应结构域。这款疗法能特异性地靶向gp100,一种在黑色素细胞和黑色素瘤中表达的抗原。这项批准创下了多个第一:它是FDA批准的首款治疗不可切除或转移性葡萄膜黑色素瘤的疗法。它同样是首款获得监管批准的T细胞受体(TCR)疗法,以及首款获FDA批准的治疗实体肿瘤的双特异性T细胞接头。
Vonjo(pacritinib)
CTI BioPharma
Vonjo在今年二月获批,治疗伴有严重血小板减少症的骨髓纤维化(myelofibrosis)患者,这是骨髓癌的一种类型。Pacritinib是一款新型的口服激酶抑制剂,能特异性抑制JAK2、IRAK1和CSF1R。因为它不针对JAK1,因此可以避免抑制JAK1带来的潜在副作用。
Opdualag (nivolumab 与 relatlimab)
百时美施贵宝
今年三月获批的 “first-in-class”疗法Opdualag由固定剂量的抗LAG-3抗体药物relatlimab与抗PD-1抗体Opdivo(nivolumab)联合组成,治疗罹患不可切除或转移性黑色素瘤的成人和儿童(12岁及以上)患者。值得一提的是,relatlimab是美国FDA批准的首款LAG-3抗体,也是近十年来针对全新免疫检查点获批的首款创新癌症免疫疗法。临床数据显示,接受nivolumab单药治疗的初治转移性或不可切除的黑色素瘤患者,其中位无进展生存期为4.6个月(95% CI: 3.4-5.6)。而接受组合疗法的患者中位PFS显著延长,为10.1个月(95% CI: 6.4-15.7)。这是在转移性黑色素瘤中,首个相对于抗PD-1抗体单药治疗还能具有统计学获益的治疗方案。
Pluvicto(lutetium Lu 177 vipivotide tetraxetan)
诺华
同样是在今年三月,诺华的靶向放射性配体疗法Pluvicto获批,治疗前列腺特异性膜抗原(PSMA)阳性转移性去势抵抗性前列腺癌患者。近年来,放射性药物成为肿瘤精准治疗领域的一个重要方向。诺华的Pluvicto将结合PSMA的小分子化合物与放射性同位素连接在一起。它可与表达PSMA的前列腺癌细胞结合,并通过放射性同位素释放的辐射能量杀伤肿瘤细胞,引发细胞死亡。这也是FDA批准治疗这类患者的首款靶向放射配体疗法。
汉斯状 (斯鲁利单抗,serplulimab)
复宏汉霖
汉斯状是复宏汉霖旗下首款自主研发的创新生物药,于三月获得NMPA批准,用于经既往标准治疗失败的、不可切除或转移性微卫星高度不稳定(MSI-H)的成人晚期实体瘤适应症。泛癌种的适应症,也有望为更多患者带来全新的治疗选择。该疗法联合化疗治疗晚期或转移性鳞状非小细胞肺癌的上市申请也已获受理,有望在今年获批。
✦
突破性疗法与优先审评
✦
今年一到四月,有四款抗癌疗法获得了美国FDA授予的突破性疗法认定。从所治疗的疾病上看,有三款针对的是非小细胞肺癌,体现了这一领域的研发依旧火热。而从疗法类型上看,传统的小分子药物与新型的抗体偶联药物(ADC)各占一半。值得一提的是,这四款获得突破性疗法认定的创新疗法中,有三款尚未获批上市。它们有望在未来给全球病患带来全新的治疗选择。

Telisotuzumab vedotin
艾伯维
Telisotuzumab vedotin是艾伯维管线中研发进展最快的ADC项目,该药物靶向c-Met,以微管蛋白抑制剂MMAE作为毒性有效载荷,用于治疗在铂类药物治疗期间或治疗后发生疾病进展、c-Met过表达的晚期/转移性EGFR野生型非鳞状非小细胞肺癌患者。针对这一特定患者群体,目前尚无获批的有效抗癌疗法。一项2期临床试验的中期分析结果表明,在符合条件的受试者中,c-Met高表达组的总缓解率(ORR)为53.8%,c-Met表达水平中等组的ORR为25.0%。
CLN-081
Cullinan Oncology
CLN-081是一款不可逆的口服下一代小分子EGFR抑制剂,可选择性靶向攻击携带EGFR外显子20插入突变的细胞,同时不影响表达野生型EGFR的细胞。这款疗法有望治疗携带EGFR外显子20突变的经治非小细胞肺癌患者。在一项1/2a期临床试验中,研发人员们正在评估CLN-081在不同剂量下的疗效和安全性。
DZD9008
迪哲医药
DZD9008是一款针对EGFR/HER2外显子20插入突变设计的创新小分子化合物,首选适应症为治疗携带EGFR外显子20插入突变的非小细胞肺癌。截至2021年7月30日,全球临床试验结果显示,DZD9008在200 mg/日和300 mg/日剂量下,确认的最佳客观缓解率(ORR)分别达到45.5%和41.9%,并在脑转移患者及获批疗法疗效不佳或治疗后进展的患者中均显示疗效。
在一月到四月间,共有七款抗癌疗法获得了美国FDA授予的优先审评资格,其中大多为原先已批准的疗法进一步扩大适应症。由阿斯利康/第一三共带来的重磅抗体偶联药物Enhertu也再次成为关注焦点,共斩获两项优先审评资格。而在尚未获批的疗法中,一款靶向FGFR1-4,另一款则靶向CTLA-4。
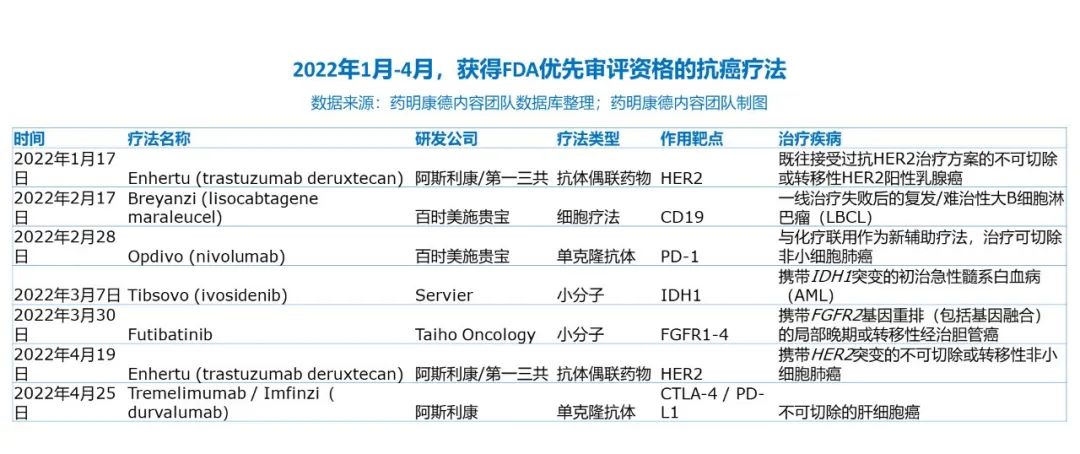
Futibatinib
Taiho Oncology
日本大鹏药品(Taiho Pharmaceutical)和旗下Taiho Oncology在三月宣布,美国FDA已经接受futibatinib的新药申请(NDA),用于治疗携带FGFR2基因重排(包括基因融合)的局部晚期或转移性胆管癌经治患者。Futibatinib是一款强力选择性不可逆FGFR1、2、3、4口服小分子抑制剂。FDA同时授予这一申请优先审评资格,预计在今年9月30日之前做出回复。这一申请是基于关键性2b期临床试验的数据,103名患者接受了futibatinib的治疗。临床试验的主要终点为客观缓解率(ORR),futibatinib的ORR为41.7%,关键性次要终点为缓解持续时间(DOR),futibatinib的中位DOR为9.7个月,72%获得缓解的患者DOR超过6个月。
Tremelimumab / Imfinzi
阿斯利康
今年四月,阿斯利康在研CTLA-4抗体tremelimumab递交的生物制品许可申请被美国FDA接受,并将通过优先审评渠道接受审评,预计在今年第四季度获得回复。该疗法将与抗PD-L1抗体Imfinzi(durvalumab)联用,治疗不可切除的肝细胞癌患者。一项3期临床试验中,接受该方案治疗的患者的死亡风险与活性对照组相比降低22%(HR=0.78,96.02% CI,0.65-0.93,p=0.0035)。接近三分之一(31%)的患者生存期超过3年,活性对照组这一数值为20%。
✦
预期未来上市
✦
除了上述提到的数款疗法之外,还有多款抗癌药物也在今年一月到四月间有着积极进展——它们抑或提交了新药上市申请,或者取得了积极的3期临床结果。展望未来,这些创新疗法同样可能顺利问世,造福更多病患。

Momelotinib
Sierra Oncology
今年一月,Sierra Oncology公司宣布其强效的在研选择性口服JAK1、JAK2和ACVR1抑制剂momelotinib,在治疗骨髓纤维化患者的一项关键性3期临床试验中达到所有主要和关键次要终点:相比安慰剂组,momelotinib组更多患者达到总体症状评分(TSS)比基线降低50%以上的标准。基于这些积极结果,该公司计划在今年第二季度向美国FDA递交新药申请(NDA)。
Mirvetuximab soravtansine
ImmunoGen
ImmunoGen在今年三月公布了靶向叶酸受体α(FRα)的抗体偶联药物(ADCs)mirvetuximab soravtansine的关键性3期临床试验结果。试验结果显示在对含铂疗法耐药的经治晚期卵巢癌患者中,mirvetuximab单药治疗显示出有临床意义的抗肿瘤活性、一致的安全性和良好的耐受性。根据目前获得的结果,该公司已在当月向美国FDA递交了该药的生物制品许可申请(BLA)。
I131-omburtamab
Y-mAbs Therapeutics
Y-mAbs Therapeutics在四月向美国FDA提交了放射性免疫疗法I131-omburtamab的生物制品许可申请(BLA),治疗儿童神经母细胞瘤。Omburtamab是一种在研单克隆抗体,靶向广泛表达于几种癌细胞中的免疫检查点分子B7-H3。通过将放射性碘(I131)与靶向B7-H3的抗体结合,可以在杀死癌细胞的同时,降低对健康细胞的毒性。在关键性2期临床试验中, 10名患儿在接受治疗26周后,疾病控制率达到90%,其中包括两名部分缓解和两名完全缓解患者。
I/ONTAK
Citius Pharmaceuticals
Citius Pharmaceuticals在今年四月宣布,其在研疗法I/ONTAK在治疗持续或复发皮肤T细胞淋巴瘤患者的关键性3期临床试验中获得积极顶线结果。I/ONTAK是一种重组融合蛋白,将IL-2受体结合域与白喉毒素片段结合在一起。它可以特异性与细胞表面的IL-2受体结合,导致白喉毒素进入细胞,抑制蛋白合成。这款疗法可以杀死癌变T细胞,并且暂时清除调节性T细胞(Treg),从而增强抗癌免疫反应。在一项研究中,独立审查委员会评估认为该疗法达到36.2%的客观缓解率(95% CI,25.0%,48.7%)。基于这一结果,该公司预计在今年下半年向美国FDA递交生物制品许可申请。
KN046
康宁杰瑞
康宁杰瑞于今年三月宣布其自主研发的PD-L1/CTLA-4双抗KN046首个3期临床研究完成首次中期分析,达到预设终点。由独立数据监察委员会进行的第一次期中分析,在意向性治疗(ITT)人群中,基于盲态独立影像评审委员会的评估,KN046联合含铂化疗,对比安慰剂联合含铂化疗在晚期鳞状非小细胞肺癌患者中,获得了显著且具有临床意义的无进展生存期(PFS)延长。康宁杰瑞将基于这个结果按计划递交KN046针对该适应症的新药上市申请,联合化疗一线治疗鳞状非小细胞肺癌。
✦
早期投融资进展
✦
如果我们将目光放到更长远的未来,又有哪些突破性的创新正在萌芽,有望在未来长成参天大树?让我们不妨看向今年获得大额早期融资的新锐公司。属于未来的癌症突破,可能就来自它们之中。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..