日前,复星凯特第二款CAR-T细胞治疗药物FKC889针对既往接受过二线及以上治疗后复发或难治性套细胞淋巴瘤(简称r/r MCL)的临床试验申请(IND)获中国国家药品监督管理局(NMPA)批准。
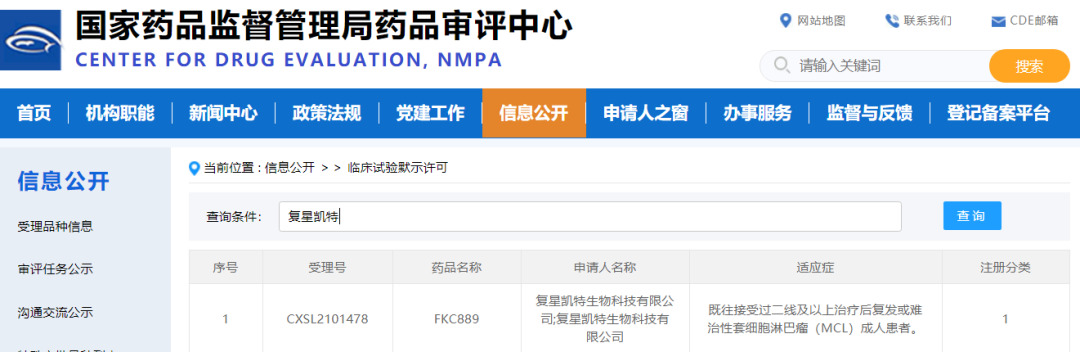
KC889是复星凯特从美国Kite(吉利德旗下公司)引进Tecartus (brexucabtagene autoleucel)在中国进行产业化、商业化的CAR-T细胞治疗药物,也是复星凯特在血液肿瘤领域的第二款CAR-T细胞治疗药物。Tecartus于2020年7月和12月分别获得美国FDA和欧盟上市批准,是目前全球首个也是唯一一个获批用于治疗复发难治性套细胞淋巴瘤成人患者的CAR-T细胞疗法,现已在全球33个国家和地区获批上市。其单臂、多中心、开放性的关键性临床试验研究ZUMA-2的结果显示,截至 2019 年 12 月 31 日,中位随访17.5个月,客观缓解率(ORR)为92%,其中完全缓解(CR)率为67%,在所有疗效可评估的患者 (n=60) 中,48% 的患者在数据截止时仍处于持续缓解状态。在所有患者 (n=68) 中,3级及以上细胞因子释放综合征CRS发生率为15%,3级及以上神经毒性的发生率为31%。
目前,复星凯特已有一款CAR-T产品获批上市——即2021年6月在国内获批上市的阿基仑赛注射液(商品名:奕凯达),用于治疗二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者,包括弥漫性大B细胞淋巴瘤(DLBCL)非特指型、原发性纵隔B细胞淋巴瘤(PMBCL)、高级别B细胞淋巴瘤和滤泡淋巴瘤转化的DLBCL。
目前阿基仑赛注射液虽然不在医保报销范围内,但已被纳入超过40项商业保险,21个省市的城市定制型商业补充保险(惠民保)。近日,北京京惠保首例CAR-T细胞治疗药已完成理赔,100万理赔款已到账。该患者花费79元购买的京惠保,后于2020年12月被确诊为淋巴瘤。另值得一提的是,产品上市半年多来,复星凯特已经与全国25个省市的75家医院合作,建立了阿基仑赛细胞治疗中心,为患者提供规范化的就近CAR-T治疗。
另值得关注的是,细胞治疗企业科济药业也宣布了其重磅产品的临床进展。
今日(3月3日),科济药业宣布其自主研发的CAR-T细胞候选产品CT041获国家药监局药审中心同意进入确证性Ⅱ期临床试验,主要治疗既往接受过至少二线治疗失败的Claudin18.2(CLDN18.2)表达阳性的晚期胃癌/食管胃结合部腺癌(GC/GEJ),该试验旨在评估CT041治疗晚期胃癌/食管胃结合部腺癌的有效性和安全性。截至目前,CT041为全球首个且唯一进入到确证性Ⅱ期临床试验的用于治疗实体瘤的CAR-T细胞候选产品。
CT041作为一种潜在全球同类首创(First-in-class)的、针对CLDN18.2靶点的自体CAR-T细胞候选产品,在临床试验中表现出前景光明的治疗效果及良好的安全性。2021年9月ESMO大会公布的研究者发起试验最新数据表明,在既往接受至少2线治疗失败、接受II期推荐剂量(RP2D) 2.5×10⁸ CT041细胞治疗的18例胃癌/食管胃结合部腺癌患者中,客观缓解率达61.1%。历史数据表明,至少2线治疗失败的胃癌患者,化疗药物或抗血管生成多激酶抑制剂的客观缓解率约为4%~8%,抗PD-1单抗的客观缓解率约为11%。
此前,CT041已被美国FDA授予“孤儿药”资格和“再生医学先进疗法”(RMAT)资格,在欧洲药品管理局,CT041同样被授予“孤儿药产品”资格和“优先药物”(PRIME)资格。
文 | 医谷
关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..