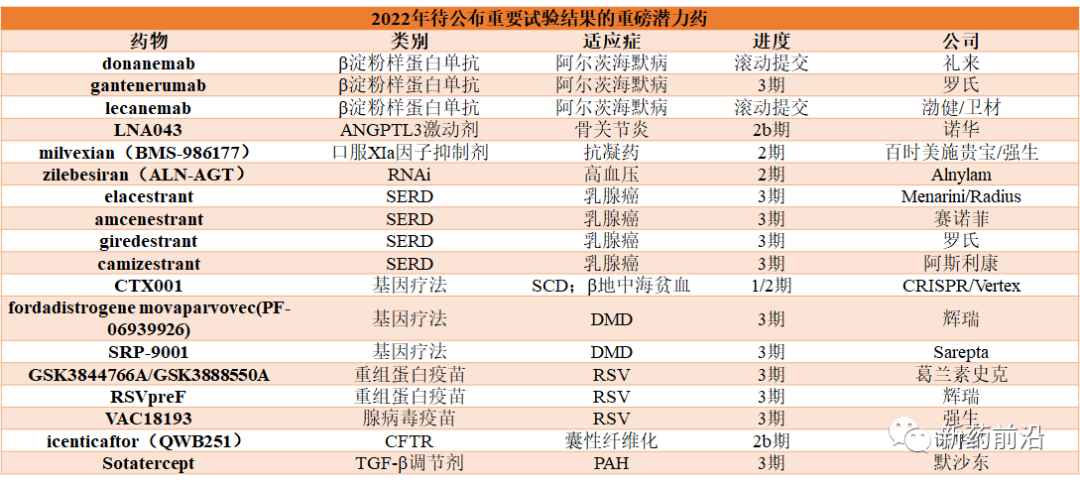
目前,在包括癌症、中枢神经系统疾病、心血管疾病和关节炎,以及罕见病等领域,有多款具有重磅潜力疗法的药物进入到临床试验晚期阶段,将在2022年公布研究数据。试验结果将会决定着这些药物未来的下一步开发计划,监管批准甚至未来的市场命运,备受业界关注。
1 AD重新焕发激情
渤健/卫材的靶向β淀粉样蛋白阿尔茨海默病(AD)药物Aduhelm(aducanumab)获批成为2021年最大监管里程碑和争议事件之一。尽管如此,Aduhelm的批准增强了具有同类药物其他开发者的决心,纷纷推进各自药物的申请批准计划,对这些项目至关重要的数据也将于2022年公布。
礼来已2021年10月开始对其候选药物donanemab向FDA滚动提交生物制品许可申请(BLA),计划在2022年第一季度完成。该提交基于2期数据,使用淀粉样蛋白斑块的清除作为临床疗效的替代标志物。礼来希望donanemab在2022年末获得该药物的批准,并且正在同时进行一项验证性的3期试验和一项预防性研究。donanemab与Aduhelm头对头试验的初步数据也将会在2022年公布。
罗氏的gantenerumab也正在进行3期试验,将于2022年下半年公布结果。几年前gantenerumab未能通过3期试验,但罗氏认为以更高的剂量可以提高其清除淀粉样蛋白疗效,从而使该项目重新复活。罗氏还将尝试开发gantenerumab的皮下给药途径。
与此同时,渤健/卫材还在开发lecanemab,2021年9月向FDA滚动提交。正在进行的一项3期试验,结果将于2022年9月公布。
2 传统领域求新 骨关节炎
骨关节炎通常易被生物制药行业所忽视的领域。然而,诺华逆势而上,目前正在进行一种新药血管生成素样3(ANGPTL3)激动剂LNA043的2b期试验。LNA043于9月获得了FDA的快速通道指定。
LNA043由诺华生物医学研究所(NIBR)开发,是人类ANGPTL3的改良重组版本,可促使关节中的细胞再生软骨,通过直接注射到病变关节中给药。如果成功,该药可能成为解决骨关节炎疾病中发生的潜在软骨损伤新型疗法。
2b期试验预计将在2022年底之前公布首批结果,但后续研究将于2024年才能完成。
抗凝药
11月,百时美施贵宝和合作伙伴强生公司报告了milvexian(BMS-986177)的第一个概念验证数据。milvexian是百时美施贵宝重磅抗凝药Eliquis(阿哌沙班)的后续产品,该药有望成为市场上第一个口服XIa因子抑制剂。
milvexian可以与Eliquis和强生/拜耳的Xarelto(利伐沙班)等靶向Xa因子的药物的疗效相匹配,但避免出血副作用的风险升高。
AXIOMATIC-TKR试验的结果表明,milvexian可预防接受全膝关节置换手术的静脉血栓栓塞(VTE),而不会增加出血风险。这些数据已在2021年的美国心脏协会(AHA)大会上公布,并同时发表在《新英格兰医学杂志》上。
现在,所有人的目光都集中在第二个中期试验AXIOMATIC-SSP上,旨在研究milvexian在预防中风或短暂性脑缺血发作患者继发性中风方面的潜力。AXIOMATIC-SSP将于2022年上半年公布结果。
高血压
RNA干扰(RNAi)或基因沉默药物由于可降低某些慢性疾病患者给药频率仍旧是极具诱惑的技术领域之一。
Alnylam的RNAi药物zilebesiran(ALN-AGT)靶向血管紧张素原(AGT),进而调节体内血压,且每年仅需给药两次或四次。在1期试验中,zilebesiran在12周内具有良好的耐受性,单次注射即可持久、剂量依赖性地降低血液中的AGT水平并改善收缩压。
Alnylam已开始一项针对轻度至中度高血压(KARDIA-1)的2期试验,该试验正在对约375名患者进行该药物作为单一疗法的测试,以查观察其是否有助于安全地控制血压,结果将于2022年底公布。Alnylam还计划启动第二项规模稍大的2期试验(KARDIA-2),该试验将在大约800名未控制的高血压患者中检查该药物作为传统降压药的附加疗法的潜力。
3 SERD迎突破
2022年,口服选择性雌激素受体降解剂(SERD)将成为乳腺癌领域广泛使用的注射药物替代品。
SERD的开发一直是在阿斯利康、罗氏和赛诺菲之间的角逐,Menarini/Radius加入后,迅速处于领先地位。
Menarini和Radius于2021年10月报告了合作开发elacestrant的3期试验的顶线数据,2022年将在美国和欧洲提交上市申请。两家公司计划在近期发布完整的数据,有望超越罗氏giredestrant、赛诺菲amcenestrant和阿斯利康camizestrant,首先获得批准上市。
与此同时,赛诺菲在其AMEERA-3研究延迟之前一直处于领先地位,amcenestrant作为二线疗法,可能在2022年初公布结果。在SERENA-2试验中,阿斯利康的camizestrant有类似的试验设计和研究时间表,而罗氏giredestrant的acelERA研究属于二线和三线疗法,预计在2022年上半年公布结果。
4
基因疗法热度不减
SCD/β地中海贫血
CRISPR/Vertex正在与Bluebird展开竞争,将针对罕见血液疾病镰状细胞病(SCD)和β地中海贫血的一次性基因疗法引入美国市场。
CRISR/Vertex一直在稳步更新其基因编辑疗法CTX001的1/2期试验的数据。由于这些研究患者现已全部入组,正在等待随访期结束,然后才能最终确定结果。如果一切顺利,CRISR/Vertex计划在2022年底之前向FDA提交上市申请。
CTX001是一种离体基因疗法,使用CRISPR/Cas9基因编辑来修改患者的造血干细胞,使其产生具有高水平胎儿血红蛋白的红细胞,以取代在地中海贫血和SCD中看到的有缺陷的版本。
地中海贫血试验CLIMB-111和SCD试验CLIMB-211此前数据显示胎儿血红蛋白水平增加,SCD疼痛发作减少,并可减少地中海贫血对输血的依赖。
然而,这些试验也面临一些疑问,包括其效果是否足够持久,足以让CTX001被视为对这些疾病的功能性治愈。有迹象表明胎儿血红蛋白水平会随着时间的推移而下降。安全是另一个考虑因素,CTX001治疗中出现了一些不良事件。
Bluebird的地中海贫血症疗法Zynteglo(betibeglogene autotemcel或beti-cel)2019年在欧洲获得批准,但在2021年夏未能在德国达成定价协议后完全退出欧洲。9月,Bluebird向FDA提交beti-cel用于地中海贫血上市申请。
Bluebird在欧洲遭遇的困境也许为Vertex/CRISPR提供了一个机会。
DMD
杜氏肌营养不良症(DMD)基因疗法的开发正在形成一场三强竞争的格局:辉瑞、Sarepta和Solid Bio都在致力于开发以促进肌营养不良蛋白产生的基因疗法,可能会在2022年进入最后冲刺阶段。
辉瑞是第一个将其fordadistrogene movaparvovec(PF-06939926)候选药物推进3期临床试验阶段的公司,但在报告了三例肌肉无力(包括心脏组织炎症或心肌炎)病例后,该公司被迫收紧了其入组标准。目前,所有登记的患者都在欧洲和亚洲,因为FDA尚未批准辉瑞开始在美国用于治疗患者。尽管辉瑞仍预计该试验将在2022年底之前公布结果,但实际上将不得不推迟时间表。
与此同时,Sarepta正在对其候选药物SRP-9001进行3期EMBARK试验,该试验于2021年10月开始。不过,这并不是Sarepta在2022年的关键读数。该公司正在等待其中期研究的第二个数据集,在2021年初报告第一阶段数据时未达到主要终点。SRP-9001确实显示出改善DMD患者步行能力的趋势,但没有统计学意义,因此2022年的数据将是SRP-9001潜力的关键指标。如果是积极的,Sarepta可能会提前向FDA提交上市申请。
另一个基因治疗竞争者Solid Bio的SGT-001开发速度略落后于其两个竞争对手。Solid在2021年的1/2期研究中期结果令人失望。该研究于2019年因肝脏和血小板副作用被FDA推迟。Solid将在开始对更多患者进行试验。
到2022年底,三种基因疗法的潜力将会更加清晰。
5 RSV:疫苗新战场
葛兰素史克、辉瑞和强生,谁将第一种呼吸道合胞病毒(RSV)疫苗推向市场,2022年应该是衡量结果的重要一年。
葛兰素史克的GSK3844766A/GSK3888550A和辉瑞的RSVpreF是重组蛋白亚单位疫苗,而强生的腺病毒疫苗VAC18193使用与其COVID-19疫苗相同的技术平台。葛兰素史克和辉瑞疫苗正在开发用于两种应用——作为一种旨在保护婴儿在生命最初几个月免受RSV感染的母体疫苗,以及作为老年人的注射剂——而强生目前主要专注于成人市场。
2021年,三种疫苗都在主要着眼于刺激RSV中和抗体的中期试验中取得了积极成果,并且都进入到了3期研究中,预计2022年数据将会公布。
辉瑞遥遥领先,预计将在2022年上半年报告RSVpreF在成人(RENOIR研究)和孕产妇患者(MATISSE研究)中的3期试验结果。
与此同时,葛兰素史克预计其GSK3844766A的AReSVi004研究的中期结果将于2022年在成人中提供其专有的AS01佐剂公布,并于2024年进行最终读数,以及来自其无佐剂母体注射GSK3888550A的3期试验的第一批数据。对于强生,关键数据将来自2022年下半年对VAC18193的EVERGREEN研究。
其他制药商拥有更早开发阶段的RSV候选疫苗,包括来自Moderna的基于mRNA的疫苗,该疫苗于2021年11月在成人中开始了2/3期试验。赛诺菲曾表示,预计明年将为幼儿提供减毒活RSV疫苗的1/2期结果,该公司还有针对成人市场的mRNA疫苗,计划于2023年开始临床测试。
6
罕见病追逐更高目标
囊性纤维化
诺华的icenticaftor(QWB251)是一种囊性纤维化跨膜电导调节剂(CFTR)的口服活性增效剂或开启剂,最初被用于治疗囊性纤维化遭遇挫折后,诺华正在将icenticaftor重新用作慢性阻塞性肺疾病(COPD)药物进行开发。
目前为止,研究结果是喜忧参半。
在一项概念验证研究中,与安慰剂相比,在患者使用支气管扩张剂前后测量的基线肺功能变化方面,icenticaftor取得了适度的改善。该药还改善了炎症的生物标志物并减少了痰细菌定植。
但该药物未能实现该研究的主要目标,即减少肺部感染,这是COPD的常见并发症。然而,诺华有足够的信心开始一项2b期剂量范围研究。现在已经完成招募,结果将于2022年上半年公布,3期研究计划将于2023年进行。
icenticaftor还正在进行另一项用于支气管扩张症的平行概念验证研究。
PAH
默沙东以115亿美元收购Acceleron是2021年最大的生物技术并购交易之一,该项交易的焦点就是肺动脉高压(PAH)候选药物Sotatercept。
Sotatercept对交易至关重要,Acceleron的激进投资者试图推迟收购,以等待正在进行的3期试验的结果,希望能提高报价。
该交易的重大转折点将在2022年出现,届时Sotatercept的STELLAR试验将会公布,届时该药物在拥挤的PAH市场中的前景会变得更加清晰。
目前上市的PAH药物主要是通过松弛血管发挥治疗PAH的症状,包括内皮素受体拮抗剂(Actelion的Tracleer和Opsumit/吉利德的Letairis)、重新利用的PDE5抑制剂(Viatris的Revatio和United的Adcirca)和前列环素(United的Remodulin和Janssen的Uptravi)。
Sotatercept是一种TGF-β调节剂,旨在重新平衡BMP和激活素信号通路,这些通路被认为会导致PAH中的血管重塑。相比之下,sotatercept旨在成为解决该疾病潜在病理的第一种疗法。如果sotatercept在STELLAR中达到终点,有望成为PAH治疗的新标准。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..