美国 FDA 药品审评与研究中心(CDER)以及生物制品审评与研究中心(CBER)2021 年共批准了 60 个新药,这是继 2018 年创纪录的批准 65 个新药和生物制品之后第二次达到这一高水平。
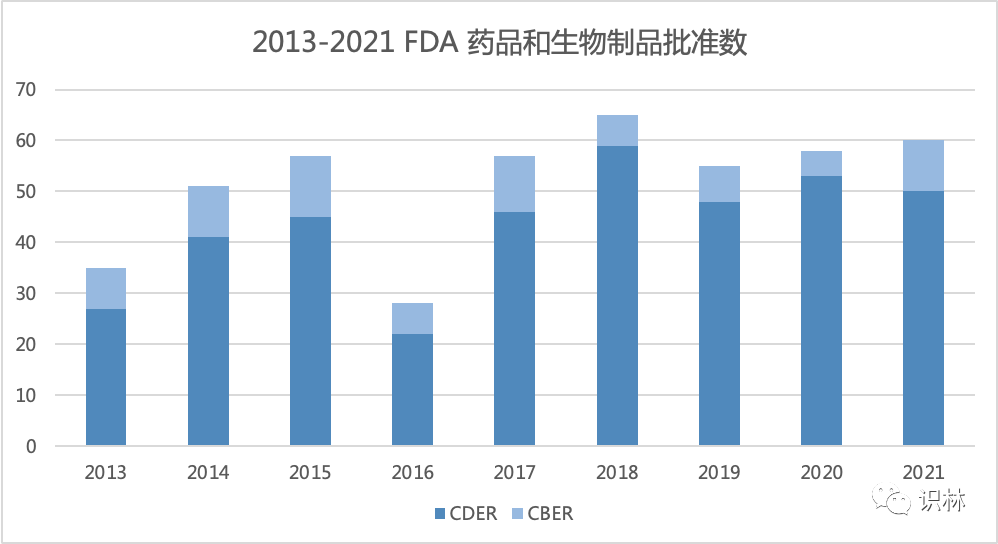
CDER 新分子实体和治疗性生物制品的批准比以往更偏重于优先审评,2021 年 CDER 批准的 50 件新药申请中包含 35 件优先审评,仅有 15 件标准申请。在过去十年中,优先审评平均占 CDER 批准的 58%;2021 年,35 件优先审评批准占 CDER 全部新药批准的 70%,仅次于 2018 年(当时的优先审评申请占四分之三)。
CBER 批准了 10 个新生物制品,其中 90% 获得了优先审评。CBER 的 10 个批准包括 5 个拥有突破性治疗认定(BTD)的生物制品和 3 个拥有再生医学高级疗法(RMAT)认定(其中两个 RMAT 批准也拥有 BTD 认定)。
CDER 2021 年批准的新分子实体和治疗性生物制品的三分之一(17 个)在获批时拥有 BTD 认定,这一数字近年来保持一致。
CBER 2021 年的批准主要是由疫苗推动的,有 5 个新批准,包括首个获得 BLA 批准的新冠疫苗 — 辉瑞/BioNTech 公司的 Comirnaty,以及两个突破性认定的肺炎球菌疫苗。另外,CBER 去年还批准了两个新型嵌合抗原受体 T 细胞(CAR-T)疗法。
不过 FDA 的高批准数量并不是 FDA 标准降低的结果。FDA 在过去几年中一直在向新药申请人发出更多完全回应函(CRL)。2021 年至少有 18 个新药收到了 FDA 的 CRL。这一数字自 2018 年以来一直都在稳步增加:2018 年 9 封 CRL,2019 年 12 封,2020 年 14 封。
作者:识林-蓝杉
协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..