面对巨大的需求,结合当下各项政策优化鼓励创新的环境,未来抗肿瘤药市场还将会迎来新的挑战和竞争。
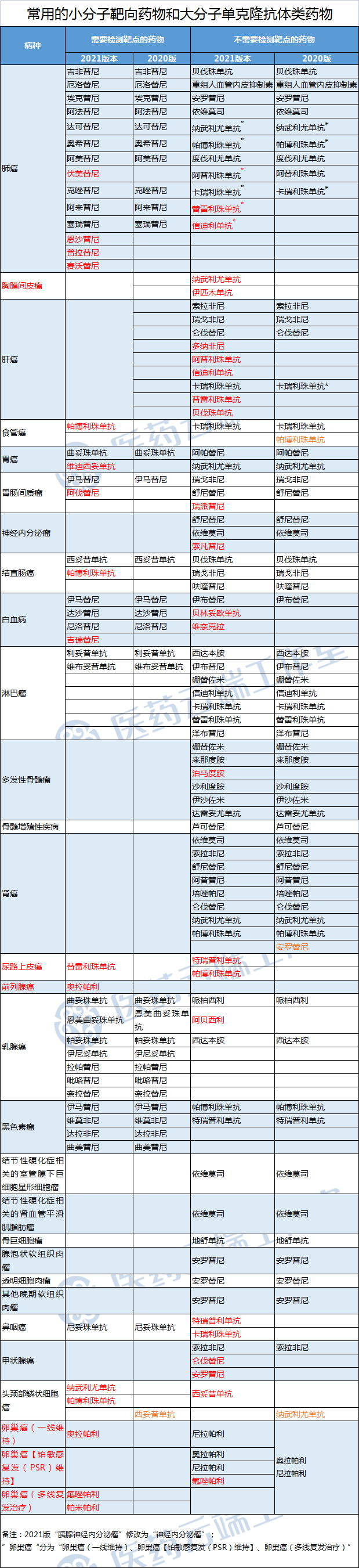
12月27日,国家卫健委发布《新型抗肿瘤药物临床应用指导原则(2021年版)》,这是自2018年首版发布后的第三个版本。与2020版对比,新增5个病种,抗肿瘤新药适应症29个(同一药物不同瘤种拓展适应症重复计数)(具体见文末附表)。
值得注意的是,《指导原则》对抗肿瘤药物超说明书用药行为做了进一步的规范。《指导原则》要求抗肿瘤药物临床应用须遵循药品说明书,不能随意超适应证使用。
在抗肿瘤药物临床应用过程中,发现新的具有高级别循证医学证据的用法但药品说明书中未体现的,医疗机构和医务人员可及时向药品生产厂商反馈,建议其主动向国家药品监督管理部门申报,及时更新相应药品说明书,以保证药品说明书的科学性、权威性,有效指导临床用药。特别是有条件快速批准上市的药品,更应当保证药品说明书的时效性。
对肿瘤治疗过程中的特殊情况下药物合理使用问题进行了明确规范。在尚无更好治疗手段等特殊情况下,医疗机构应当制定相应管理制度、技术规范,对药品说明书中未明确、但具有循证医学证据的药品用法进行严格管理。
特殊情况下抗肿瘤药物的使用权应当仅限于三级医院授权的具有高级专业技术职称的医师,充分遵循患者知情同意原则,并且应当做好用药监测和跟踪观察。
《指导原则》指出,特殊情况下抗肿瘤药物循证医学证据采纳根据依次是:其他国家或地区药品说明书中已注明的用法,国际权威学协会或组织发布的诊疗规范、临床诊疗指南,国家级学协会发布的经国家卫生健康委员会认可的诊疗规范、临床诊疗指南和临床路径等。
近年来,国家陆续出台多个文件,对抗肿瘤药物临床使用进行规范化。
在2020年12月28日,国家卫健委印发抗肿瘤药物临床应用管理办法(试行)的通知,该《办法》共五章48条,对医疗机构内抗肿瘤药物的遴选、采购、储存、处方、调配、临床应用和药物评价等,进行全过程管理。办法明确将对抗肿瘤药实行分级管理,并启动全国临床应用监测网。
2021年6月28日,国家卫健委印发《抗肿瘤药物临床合理应用管理指标(2021年版)》,共涉及限制使用级和普通使用级抗肿瘤药物的使用率等6个指标。此次该《指标》发布,意在指导医疗机构科学设定抗肿瘤药物临床应用管理指标,提高抗肿瘤药物临床合理应用水平。
2021年7月2日,CDE发布通知,就《以临床价值为导向的抗肿瘤药物临床研发指导原则》向社会公开征求意见,虽是意见稿,但大体上格局基本明确。
意见稿明确提出:“新药研发应以为患者提供更优的治疗选择为最高目标,当选择非最优的治疗作为对照时,即使临床试验达到预设研究目标,也无法说明试验药物可满足临床中患者的实际需要,或无法证明该药物对患者的价值。”
这份文件对抗肿瘤药的研发提出了比以往更高的要求。从研发端开始,药品立项的导向变了,这对于跟风乱立项的药企可谓是当头一棒,直接喝退。
据米内网数据显示,近年来中国公立医疗机构终端抗肿瘤药的销售规模快速上涨,市场增速从2016年的12.44%增长至2019年的21.30%,而市场规模则是涨至961亿元。在2020年上半年,尽管受到疫情影响,但抗肿瘤和免疫调节剂作为刚需用药,其所在大类的销售额占比提升至16.95%,同比增长更是达到13.81%。
随着新版指导原则的印发,抗肿瘤药物使用也将越来越规范化,可以预见,面对巨大的需求,结合当下各项政策优化鼓励创新的环境,未来抗肿瘤药市场还将会迎来新的挑战和竞争。
关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..