近日,知名投行Torreya发布了《全球1000强药企报告》,按估值对全球前1000家药企(Pharma)进行了排名,Torreya还对欧洲生物医药(Biotech)公司估值进行了排名,评选出了前18强。这18强公司各具亮点,专注领域覆盖双特异性抗体、抗体偶联药物、基因编辑、基因疗法等热门产品/技术。本文精选其中5家生物医药公司进行相关介绍。
1.Genmab
Genmab成立于1999年,总部位于丹麦哥本哈根,是一家多元化抗体药物研发公司,专注于癌症抗体疗法的研发。官网资料介绍,受到大自然的启发及数据的驱动,对患者的承诺推动其利用抗体生物学专业知识来追求和研发差异化的新一代癌症治疗方法。Genmab拥有4类抗体药物研发平台,DuoBody、HexaBody、DuoHexaBody和HexElect,正通过这4大抗体药物研发平台开发超过20个处于临床阶段在研管线,并已通过这些技术平台开发出5款获批上市的抗体药物。仅成立1年后,Genmab即在哥本哈根和法兰克福上市,IPO募集资金约2.26亿美元。2019年7月,Genmab在纳斯达克上市。
达雷妥尤单抗皮下注射剂(英文商品名:Darzalex Faspro)是Genmab和杨森(Janssen)联合开发的首款可以通过皮下注射给药的抗CD38抗体,是由达雷妥尤单抗和重组人透明质酸酶PH20(rHuPH20)组成的固定剂量复方,可将患者接受治疗的时间从几个小时缩短到几分钟。今年10月,该药物在中国获批上市,用于治疗原发性轻链型淀粉样变患者;此前,该药物已获美国FDA批准治疗多发性骨髓瘤、轻链(AL)淀粉样变性等适应症。另外,Genmab还和Seagen联合开发了“first-in-class”的抗体偶联药物Tivdak,今年9月,美国FDA已加速批准其上市,用于治疗复发或转移性宫颈癌患者,她们的疾病在接受化疗治疗后出现进展。新闻稿指出,这是治疗该患者群体的首款获批抗体偶联药物(ADC)。此外,Genmab还和艾伯维(AbbVie)联合开发了在研CD3/D20双特异性抗体epcoritamab,拟用于治疗复发/难治性B细胞非霍奇金淋巴瘤(B-NHL)患者。今年9月,该药物的1/2期临床试验EPCORE NHL-1结果在著名学术期刊《柳叶刀》杂志上发布,试验中报告的初步疗效结果显示,患者达到88%的总缓解率(ORR)和38%的完全缓解(CR)。
2.Argenx
Argenx成立于2008年,总部位于荷兰布雷达,是一家免疫学公司,致力于改善严重自体免疫性疾病患者或癌症患者的生活质量。该公司基于其免疫学创新计划(IIP),通过与许多优秀的学术研究人员合作,致力于将免疫学领域的学术突破转化为潜在“first-in-class”新型抗体药物。Argenx拥有基于美洲驼免疫系统的SIMPLE抗体平台以及三种抗体Fc工程技术,能够开发新颖、复杂的靶标,并且提高候选药物的疗效。Argenx在美国、比利时、日本都设有办事处。2017年5月,Argenx正式登陆纳斯达克,募资9970.5万美元。
Efgartigimod是Argenx公司开发的一款潜在“first-in-class”的、靶向FcRn的在研抗体片段,旨在减少致病性免疫球蛋白G(IgG)抗体并阻断IgG循环。Efgartigimod可与FcRn结合,通过阻断FcRn可降低IgG抗体表达水平,进而治疗多种已知由致病IgG抗体驱动导致的自身免疫性疾病。Efgartigimod在治疗抗乙酰胆碱受体(AChR)抗体阳性全身性重症肌无力(gMG)患者的关键性3期临床试验ADAPT中,达到了主要研究终点,67%患者症状显著改善。今年1月,再鼎医药以总计1.75亿美元的合作付款获得efgartigimod在大中华区的独家开发和商业化权利。目前,该产品已在美国提交治疗全身型重症肌无力的上市申请,并正在中国开展针对原发免疫性血小板减少症患者的3期、多中心临床试验。
3.CRISPR Therapeutics
CRISPR Therapeutics成立于2013年,总部位于瑞士巴塞尔,致力于利用其专有的CRISPR/Cas9基因编辑平台开发转化药物,公司科学创始人为去年诺贝尔化学奖得主Emmanuelle Charpentier博士。CRISPR/Cas9是一种特定、高效且通用的基因编辑技术,可以利用它来修改、删除或纠正DNA的精确区域。CRISPR Therapeutics正在应用这一技术,通过破坏、纠正或调控疾病相关基因来治疗广泛的疾病。2016年10月,CRISPR Therapeutics正式登陆纳斯达克,募资9188.5万美元。今年4月,Vertex医药公司和CRISPR Therapeutics公司宣布已经更新了联合开发在研基因编辑疗法疗法CTX001的合作协议,修订后的协议中合作金额最高达11亿美元。
CRISPR Therapeutics的CTX110是一款利用CRISPR基因编辑技术改造的同种异体CAR-T细胞疗法,用于治疗CD19阳性的B细胞恶性肿瘤患者。该药物将靶向CD19抗原的嵌合抗原受体(CAR)定位敲入细胞的天然T细胞受体(TCR)位点,在引入CAR的同时防止内源性TCR的表达,从而防止移植物抗宿主病(GvHD)的产生。同时,它还利用基因编辑敲入了1型主要组织相容性复合体的表达,降低患者的免疫系统对输入的细胞疗法的攻击。CTX001已获得美国FDA授予治疗输血依赖性β地中海贫血(TDT)和严重镰刀型细胞贫血病(SCD)的再生医学先进疗法(RMAT)认定、以及快速通道和孤儿药资格。它还获得欧洲药品管理局(EMA)授予的优先药物(PRIME)资格,用于治疗镰刀型细胞贫血病。今年6月公开的临床试验数据显示,所有接受CTX001治疗的TDT或SCD患者均获得缓解。此外,ViaCyte和CRISPR Therapeutics联合开发了CRISPR基因编辑的干细胞衍生疗法VCTX210,已于今年11月中旬获加拿大卫生部批准进行临床试验,用于治疗1型糖尿病(T1D)。新闻稿指出,这是用于治疗1型糖尿病患者的首款进入临床试验阶段的基因编辑细胞替代疗法。
4.ADC Therapeutics
ADC Therapeutics成立于2011年,总部位于瑞士沃州,致力于为患有血液系统恶性肿瘤和实体瘤的患者开发高效和针对性强的抗体偶联药物(ADC),并将其商业化。该公司由阿斯利康(AstraZeneca)和惠氏(Wyeth)的“老将”Chris Martin博士和Jay Feingold博士领导。ADC Therapeutics利用专有的下一代吡咯并苯并二氮杂(PBD)技术来开发ADC。ADC是一类由靶向特定肿瘤相关抗原的单克隆抗体和偶联在该抗体上的有效载荷构成的新型药物,将单克隆抗体的靶向递送与有效载荷的肿瘤杀伤潜力结合。ADC Therapeutics的临床研究实验室遍及美国和欧洲,已布局多条在研管线,适应症涵盖复发或难治性弥漫大B细胞淋巴瘤、头颈部癌、胰腺癌、滤泡性淋巴瘤等。去年5月,ADC Therapeutics正式在纽交所上市,完成超额IPO约2.327亿美元。
ADC Therapeutics的Zynlonta由人源化的抗CD19单克隆抗体与PBD二聚体细胞毒素连接构成,一旦与表达CD19的细胞结合,它就能够被细胞内化,并释放细胞毒素,最终导致细胞的死亡。今年4月,美国FDA已加速批准Zynlonta上市,作为单药治疗复发/难治性大B细胞淋巴瘤成人患者。新闻稿指出,这是首款获得美国FDA批准靶向CD19的抗体偶联药物(ADC)。值得一提的是,由高瓴资本支持的瓴路药业(Overland Pharmaceuticals)通过与ADC Therapeutics公司成立合资公司Overland ADCT BioPharma,获得ADC Therapeutics的独家授权,拥有在大中华区和新加坡开发并推广这一创新ADC的权益。此外,ADC Therapeutics还在推进多款候选药物的临床开发。Camidanlumab tesirine(Cami)是一款靶向CD25的在研新型ADC,今年6月已在治疗复发/难治性霍奇金淋巴瘤患者的关键性2期临床试验中获得积极结果,经过大量前期治疗的患者接受Cami治疗后,达到66.3%的总缓解率(ORR)与27.7%的完全缓解率(CRR)。今年9月,ADC Therapeutics靶向肾相关抗原1(KAAG1)的在研ADC ADCT-901也已经完成1期临床试验的首例患者给药,用于治疗具有高度未竟需求的某些晚期实体瘤患者(包括经治卵巢癌和三阴性乳腺癌)。
5.uniQure
uniQure于1998年成立,总部位于荷兰,致力于血友病B、亨廷顿病、法布里病、脊髓小脑共济失调3型和其他疾病基因疗法的研发。去年6月,uniQure公司宣布与CSL Behring达成一项总额超20亿美元的研发许可协议,授予CSL Behring治疗B型血友病的基因疗法etranacogene dezaparvovec的全球独家权利。
2012年,欧洲药品管理局(EMA)批准了uniQure的基因疗法Glybera上市,用于逆转家族性脂蛋白脂肪酶缺乏症。由于缺乏这种酶,患者血液里的甘油三酯水平极高,而通过在患者体内表达这种酶,Glybera可有效控制他们的症状。据新闻稿,这是EMA批准的首款基因疗法。此外,uniQure还有多条在研管线,其etranacogene dezaparvovec是一款使用腺相关病毒5(AAV5)携带表达凝血因子IX(FIX)的转基因的在研基因疗法。在去年的美国血液学会(ASH)年会上公布的3期临床试验数据显示,在接受治疗26周后,这一基因疗法将患者体内FIX活性水平从基线的2%以下提高到37.2%,达到了研究的第一个主要终点。并且,在etranacogene dezaparvovec单次给药后,需要治疗的出血次数减少了91%,87%的患者在给药后未出现此类出血。报告的出血总数下降了83%。该疗法已获美国FDA授予的突破性疗法认定(BTD)和EMA授予的优先药物认定(PRIME)。uniQure计划在2021年下半年向美国FDA和EMA递交监管申请。
下表为全球知名投行Torreya于2021年11月5日发布的欧洲最具价值TOP20生物医药公司,摘自《全球1000强药企报告》。
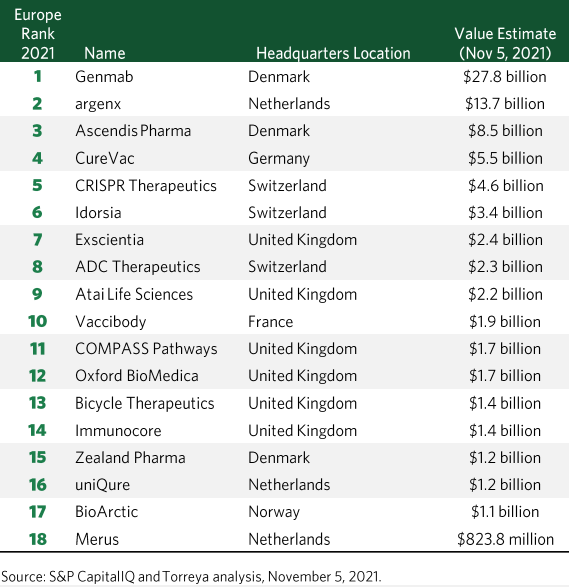
▲欧洲最具价值TOP18生物医药公司(18 Most Valuable Biotechs in Europe)榜单——Torreya,2021年11月5日
四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..