▎药明康德内容团队编辑
近日,全球知名投行Torreya发布了《全球1000强药企报告》,按估值对全球前1000家药企(Pharma)进行了排名,Torreya还对北美生物医药(Biotech)公司估值进行了排名,评选出了前18强。这18强公司各具亮点,专注领域覆盖基因编辑、细胞疗法、RNAi疗法等热门产品/技术。本文精选其中5家生物医药公司进行相关介绍。
1.Acceleron
Acceleron成立于2003年,总部位于美国马萨诸塞州,致力于为患有各种严重和罕见疾病的患者发现和开发创新的、改变生活的药物。其研究重点是利用转化生长因子-β(TGF-β)超家族生物学和蛋白质工程研发创新化合物,使人体能够调节细胞生长和修复。今年9月,默沙东(MSD)宣布与Acceleron达成最终协议,通过子公司以总金额约115亿美元收购后者。本月,默沙东完成对其收购。
Acceleron的sotatercept是一种潜在治疗肺动脉高压(PAH)的药物,作为PAH现行标准治疗的辅助治疗正在进行3期临床试验。Sotatercept是一款靶向TGF-β信号通路的在研疗法,曾获美国FDA授予突破性疗法认定(BTD)和孤儿药资格(ODD),用于治疗肺动脉高压患者。此外,Acceleron的产品组合还包括Reblozyl,这是一种“first-in-class”的血红细胞成熟剂,在美国、欧洲、加拿大和澳大利亚获批用于治疗某些罕见血液疾病的贫血症状。Reblozyl正在通过与百时美施贵宝(BMS)的全球合作进行开发和商业化,其在中国的最高研发状态为上市申请获受理且被授予优先审评资格,用于需要定期输注红细胞(RBC)的成人β-地中海贫血患者。
2.Intellia Therapeutics
Intellia Therapeutics(以下简称“Intellia”)成立于2014年,总部位于美国马萨诸塞州剑桥市,公司致力于开发基因组编辑疗法治疗罕见的遗传、肿瘤和免疫学疾病。公司的联合创始人之一是去年诺贝尔化学奖得主Jennifer Doudna教授。Intellia使用模块化的基因组编辑平台来创建涵盖多种适应症的体内和体外治疗途径,致力于基于CRISPR/Cas9的药物研发以及各种癌症和自身免疫性疾病创新细胞疗法开发。2016年,Intellia正式登陆纳斯达克,募资1.08亿美元。
Intellia的NTLA-2001是一款在体内进行基因编辑的创新疗法,它通过脂质纳米颗粒(LNP),包装靶向转甲状腺素蛋白(TTR)基因的CRISPR基因编辑系统,具有一次治疗、潜在治愈转甲状腺素蛋白淀粉样变性(ATTR)的潜力。今年6月,Intellia和再生元(Regeneron)公司宣布,NTLA-2001在1期临床试验中获得积极初步结果,受试者TTR水平平均下降87%,在第28天TTR降低幅度最大可达96%。新闻稿指出,这是首个支持体内CRISPR基因编辑安全性和效果的临床数据。此外,Intellia体内疗法管线还包括用于治疗遗传性血管性水肿(HAE)的NTLA-2002和血友病(Hemophilia)在研项目,体外疗法管线包括开发治疗镰刀型细胞贫血病(SCD)的OTQ923/HIX763、治疗急性髓系白血病(AML)的NTLA-5001和实体瘤在研项目等。
3.Arrowhead Pharmaceuticals
Arrowhead Pharmaceuticals(以下简称“Arrowhead”)总部位于美国加利福尼亚州帕萨迪纳,致力于开发通过“沉默”引起难治性疾病基因的药物来治疗疾病。利用广泛的RNA化学组合和有效的递送模式,Arrowhead开发的疗法触发细胞中天然存在的RNA干扰(RNAi)机制,诱导快速、深度和持久的敲除靶基因,从而影响其编码的“致病蛋白质”的产生。去年10月,武田(Takeda)和Arrowhead达成一项约10亿美元研发合作协议,共同开发潜在“first-in-class”RNAi疗法ARO-AAT;本月,Arrowhead宣布与葛兰素史克(GSK)达成逾10亿美元的合作协议,共同开发其在研RNAi疗法ARO-HSD。
Arrowhead官网资料显示,其RNAi技术的深度和多功能性使其能够解决几乎任何治疗领域的问题,并追求小分子和生物制品不能以其他方式成药的疾病靶标。以下精选Arrowhead研发管线中4款在研药物进行相关介绍:
ARO-AAT是一款在研RNAi疗法,拟用于治疗α-1抗胰蛋白酶相关肝病(AATLD)。ARO-AAT旨在减少突变α-1抗胰蛋白酶蛋白(AAT)的产生,它是AATLD疾病进展的根源。ARO-AAT已获美国FDA授予的突破性疗法认定(BTD)、孤儿药资格和快速通道资格。
ARO-HSD是一款在研RNAi疗法,拟用于治疗非酒精性脂肪性肝炎(NASH),可以抑制HSD17B13基因表达的HSD17β13蛋白的产生,相关研究显示,这一基因出现的功能缺失变异与脂肪性肝炎的风险降低相关。目前,它在1/2期临床试验中接受评估,取得了积极的初步结果。
JNJ-3989(以前被称为ARO-HBV)是特异性靶向肝脏递送的在研RNAi疗法,拟用于治疗慢性乙肝患者。JNJ-3989靶向所有乙型肝炎病毒(HBV)RNA,从而降低所有病毒蛋白的水平。它已授权给杨森(Janssen)公司,目前处于2期临床试验阶段。值得一提的是,该药用于慢性乙型肝炎病毒(HBV)感染在中国获纳入突破性治疗品种。
此外,Arrowhead还布局了针对晚期透明细胞肾细胞癌(ccRCC)的在研RNAi疗法ARO-HIF2等研发管线。
4.Beam Therapeutics
Beam Therapeutics(以下简称“Beam”)成立于2017年,总部位于美国马萨诸塞州剑桥市,是一家利用单碱基编辑技术开发精准基因药物的创新公司,致力于治疗遗传疾病。Beam创始人是三名CRISPR专家——哈佛大学的刘如谦(David Liu)教授、麻省总医院的Keith Joung博士、麻省理工学院Broad研究所张锋(Feng Zhang)教授。该公司的碱基编辑平台将CRISPR系统靶向特定DNA序列的特征与对DNA碱基进行化学修饰的碱基编辑酶结合起来,能够对单个碱基进行精确的编辑。与现有的基因编辑方法相比,碱基编辑能够在靶向基因组序列上造成精确、可预测的单碱基改变,并且不会造成DNA的双链断裂。2020年,Beam正式登陆纳斯达克。
今年9月,Beam公司宣布,临床前研究结果显示了其胞嘧啶碱基编辑器(CBE)在体外模型中,降低乙肝病毒表面抗原(HBsAg)表达,防止乙肝病毒水平在抗病毒药物停用后反弹,展现其在慢性乙肝病毒(HBV)感染功能性治愈潜力。慢性乙肝病毒(HBV)感染会提高肝硬化、肝功能衰竭和肝癌等危及生命的健康问题的风险。HBV感染的一个标志是在肝细胞核中持续存在共价环状DNA(cccDNA)。碱基编辑器可以在不引起双链断裂的情况下,将特定碱基转化为另一个碱基。在HBV感染的细胞中,CBE可以在cccDNA的多个位置精准引入终止密码子,从而抑制病毒基因表达。
5.Fate Therapeutics
Fate Therapeutics是一家临床阶段的生物医药公司,致力于开发用于癌症和免疫疾病的工程化细胞疗法。该公司开发“即用型”CAR-T细胞疗法的策略是通过对诱导多能干细胞(iPSC)进行基因工程改造,筛选并保存能够扩增并且可以分化为T细胞和自然杀伤(NK)细胞的iPSC细胞系。这些经iPSC细胞系分化生成的T细胞或NK细胞不会导致患者的免疫排斥反应,而且可以表达各种不同的治疗性蛋白。然后在需要时,它们可以被扩增,分化成为“即用型”T细胞或NK细胞疗法。去年4月,Fate Therapeutics宣布与杨森(Janssen)公司达成一项31亿美元全球合作协议,以利用其iPSC平台和杨森专有的抗原结合结构域,开发新型CAR-NK和CAR-T疗法。
FT596是Fate Therapeutics从一种克隆iPSC系分化生成的“即用型”CAR-NK细胞疗法,它使用了创新高亲和力、不可裂解的CD16Fc受体,旨在最大化抗体依赖性细胞介导的细胞毒性(ADCC)。今年8月,Fate Therapeutics公布FT596针对复发/难治性B细胞淋巴瘤患者的1期临床试验积极中期结果,试验结果显示,在接受FT596剂量超过9000万细胞的14名患者中,10名(71%)患者获得客观缓解,其中7名(50%)获得完全缓解。在此前未接受过靶向CD19的CAR-T疗法治疗的患者中,客观缓解率为80%(8/10)。在曾经接受过CD19 CAR-T疗法治疗的4名患者中,2名(50%)获得完全缓解。
参考阅读:
[1] 首款RNAi疗法诞生记:等了12年的“诺奖新药”
[2] 实至名归!CRISPR基因编辑系统获2020年诺贝尔化学奖
[3] 从NK细胞疗法最新临床结果,看即用型细胞疗法的未来…
[4] 2021年“亚洲最具价值TOP20生物医药公司”榜单
下表为全球知名投行Torreya于2021年11月5日发布的北美最具价值TOP18生物医药公司,摘自《全球1000强药企报告》,若需下载该报告,请在微信公众号创鉴汇回复“Torreya-2021”。
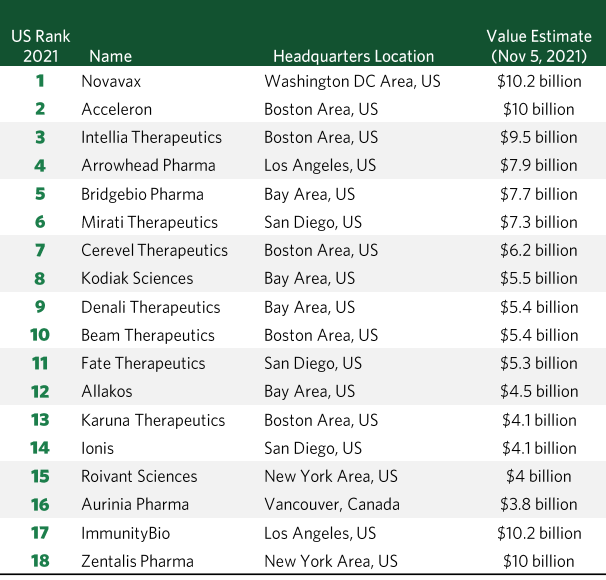
▲北美最具价值TOP18生物医药公司(18 Most Valuable Biotechs in North America)榜单——Torreya,2021年11月5日
参考资料:
[1] 2021年美国最具价值TOP18生物医药公司榜单. Retrieved 2021-11-29, from https://www.torreya.com/
[2] 各公司官网
四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..