因存在无菌保障风险,一药企召回一款注射液品种。
11月22日,FDA(美国食品药品管理局)发布了一项企业的召回公告,因留样药品中发现风险,容器密封性可能无法保证无菌,Sagent制药(赛进制药)召回Levetiracetam(左乙拉西坦)注射液。
据悉,Levetiracetam(左乙拉西坦)注射液是一种用于治疗癫痫的一种药物,适用于局部发作,肌阵挛或强直性阵挛性癫痫发作。
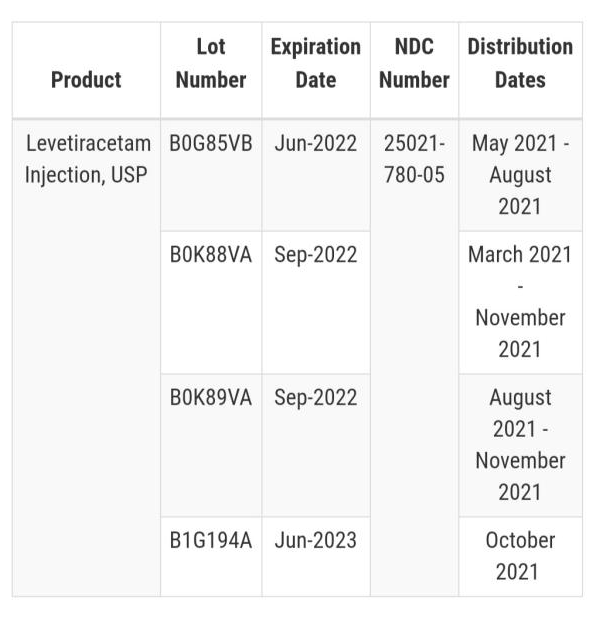
此次召回的原因并不是市场反馈下的召回,也没有收到相关投诉,是企业在进行留样检中,发现部分瓶子的密封性存在风险。这种情况可能会引起染菌导致药品变质,以及产生内毒素,引发病人的感染及高烧。其中召回的药品一共有四批次,生产日期从今年5月到10月,药品规格为500mg/5ml。
非首次召回注射剂,赛进美国制药质量安全存疑
公开资料显示,召回发起方为赛进美国制药(Sagent),总部位于伊利诺伊州,是一家通过独特全球资源网络提供丰富的注射剂产品的国际制药公司。2011年,赛进在美国纳斯达克挂牌上市。
值得注意的是,这并不是今年以来该药企首次因密封性而召回药品,在3月11日,美国赛进制药就曾主动召回三批盐酸苯肾上腺素注射液USP级别(10 mg/mL)。其召回原因是因一则客户投诉,该投诉表明西林瓶盖封存在着松动的可能性,说明产品的无菌性能不能得到保证。
据悉,盐酸去氧肾上腺素注射液是一种α-1肾上腺素能受体激动剂,用于治疗临床上显著的低血压症,这可由麻醉情况下血管扩张而引起。静脉注射的无菌制剂若处于非无菌状态,可能会导致严重的全身感染,进而危及生命。
综合来看,赛进美国制药今年召回的药品均为注射剂,而注射剂作为药品中的高风险制剂,注射入人体,起效迅速,无菌或密封如果做不到位,会产生严重的人体危害反应。从两次的召回事故看,该企业在药品质量把控方面还是存在一定质疑。
ED仿制药现质量问题,太阳药业启动召回
除了上述药企因药品质量宣布召回外,近日,还有一家药企生产的治疗ED(男性勃起功能障碍)药物他达拉非因质量问题被FDA宣布召回。
按照美国FDA的最新执法报告,由于生产质量问题,印度制药巨头太阳制药正通过其美国分公司,在美国市场召回超11万瓶他达拉非仿制药。
召回的规格为5mg×30片和20mg×30片的产品,这批药品由太阳制药在印度生产,由总部位于新泽西州普林斯顿的太阳制药分公司在美国分销。
美国FDA解释II级召回的原因时说:“生产药品时使用了不正确品级的药用辅料交联聚维酮。” 按照美国FDA的规定,II级召回是在使用违禁产品时,可能导致暂时或医学上可逆的健康危害,或者严重健康危害的可能性比较小的情况下启动。
作为印度制药行业的龙头老大,在近几年来,印度太阳制药也曾多次出现药品的质量问题。
在今年11月初,太阳制药在美国市场还发起了用于治疗过敏性鼻炎和普通感冒的 22752 个泡罩包装的氟雷他定缓释片的召回,按照美国 FDA 的说法,召回原因是水分限度不合格。
2020年9月,该公司生产的Riomet ER(盐酸二甲双胍缓释口服混悬液,500mg/5ml)因亚硝胺杂质N-亚硝基二甲胺(NDMA)的潜在含量,超过了美国FDA制定的每日允许摄入量(ADI)而召回。
2018年5月14日,国家药监局发布公告,由于存在质量风险,自即日起在中国境内暂停销售印度太阳药业生产的注射用亚胺培南西司他丁钠。
对于此次召回的两个药品,目前暂未造成影响,后续情况如何,还需持续关注。
协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..