日前,ChemoCentryx宣布FDA批准其口服选择性补体5a(C5a)受体抑制剂Tavneos(avacopan)上市,与标准疗法联用,辅助治疗两种主要的抗中性粒细胞胞浆自身抗体(ANCA)相关血管炎。新闻稿指出,这是十年来FDA首次批准ANCA相关血管炎药物,也是FDA批准的首款口服补体C5a受体抑制剂。
ANCA相关性血管炎是一种由于C5a补体途径的过度激活,进一步激活中性粒细胞,导致炎症和小血管破坏的全身性疾病,可引起器官损伤和衰竭。这是一种罕见和严重的自身免疫性疾病,对靶向疗法存在着高度未满足的医疗需求。Tavneos通过精确阻断位于中性粒细胞等炎症细胞上的C5a受体,从而降低炎症损伤。
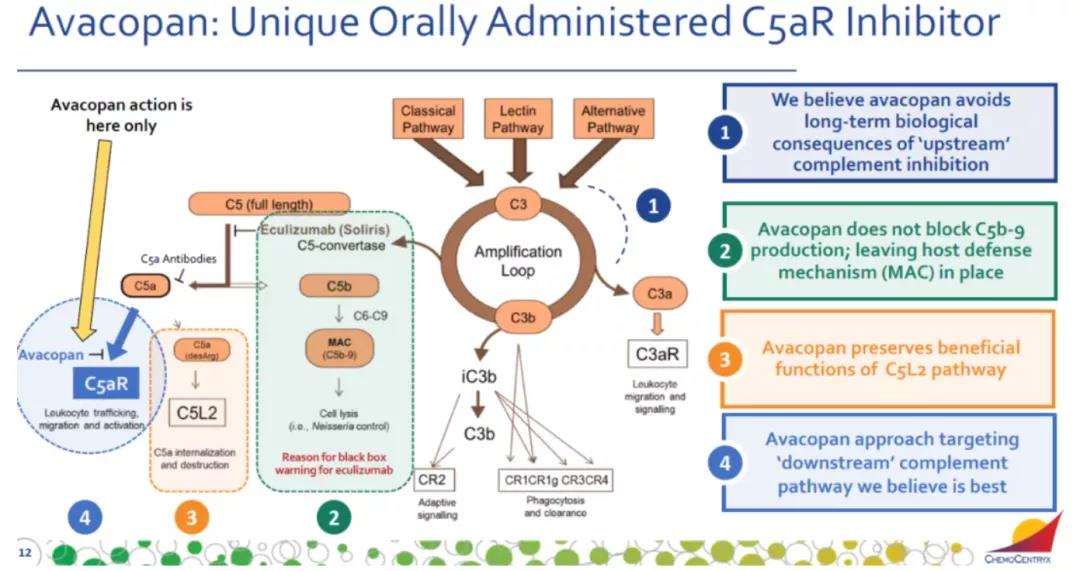
Tavneos由ChemoCentryx开发,ViforPharma拥有其在美国以外的独家商业化许可,在日本的开发和商业化独家许可授予了KisseiPharma。今年9月,Vifor及Kissei联合宣布,日本厚生劳动省(MHLW)批准Tavneos胶囊10mg在日本上市,用于治疗肉芽肿病伴多血管炎(GPA)和显微镜下多血管炎(MPA)患者,GPA与MPA正是ANCA相关性血管炎的两种主要类型。
在美国,Tavneos于2016年被FDA授予孤儿药资格,2020年7月ChemoCentryx向FDA提交NDA。此次获批,基于关键性3期试验的积极结果支持。331例多血管炎和肉芽肿伴多血管炎患者的数据显示,在治疗第52周时,Tavneos组65.7%的患者观察到持续缓解,对照药物组为54.9%;同时安全性方面,Tavneos组和对照组差别不明显。
近年来补体市场火热,目前全球已有4款补体抑制剂上市,包括Alexion公司的Soliris和Ultomiris,Apellis公司的Empaveli,以及ChemoCentryx的Tavneos,其中仅Empaveli为C3补体抑制剂,其他均为C5补体抑制。
除了已上市的几款产品,目前赛诺菲的sutimlimab、诺华的iptacopan(LNP023)、Akari公司的nomacopan、Achillion公司的danicopan、Annexon 公司的ANX005、Ra公司的zilucoplan等都在研,其中阿斯利康在去年12月以390亿美元收购了Alexion,将其一众补体药物全部收入囊中。国内,天境生物与德国MorphoSys公司就C5aR的抗体MOR210开发达成战略合作,天辰生物与艾尔健康就补体药物RX-001用于眼科疾病治疗的全球授权合作协议,协议总金额超过10亿人民币。
四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..