2019年10月,因发现了对人类以及大多数动物生存而言至关重要的“氧感知通路”,William G. Kaelin教授、Peter J. Ratcliffe教授以及Gregg L. Semenza教授获得了当年的诺贝尔生理学或医学奖。他们的发现为抗击贫血、癌症和许多其他疾病的新策略铺平了道路。

来源:The Nobel Prize官网
基于此,今年夏天有两款相关产品相继获得了监管机构的绿灯:8月13日,默沙东的HIF2α抑制剂belzutifan获美国FDA批准,这是第一种治疗希佩尔-林道综合征(Von Hippel-Lindau disease,VHL 综合征)的药物。而FibroGen的HIF-PH抑制剂roxadustat(罗沙司他 )虽遭FDA拒绝,但EMA在8月19日批准它用于治疗与慢性肾病相关的贫血。
那么,从获得诺奖的科学突破到造福患者的创新疗法,这中间到底经历了怎样的路程呢?近期,Nature Reviews Drug Discovery采访了William G. Kaelin教授,为大家分享基于氧感知通路开发疗法的经验之谈。

来源:Nature Reviews Drug Discovery
从靶点发现到药物开发
众所周知,对地球上的生物体来说,氧气非常重要。然而,长期以来人们对细胞如何适应氧气水平的变化知之甚少。例如,对缺氧的一个关键生理反应是促红细胞生成素(EPO)水平的升高,这会导致红细胞生成增加。EPO控制红细胞生成的重要性在上世纪初就已为人所知,但这一过程本身是如何由氧气控制的仍然是个谜。
上世纪90年代,Ratcliffe教授和Semenza教授探索了这一现象背后的机制,他们发现一段特殊的DNA序列似乎与缺氧引起的基因激活有关。后续研究表明,这段序列在细胞内调控了一种可以控制 EPO表达水平的“开关”——缺氧诱导因子 (Hypoxia-inducible factors, HIF)。但HIF的功能远不止开关那么简单。
HIF由HIF-1α与HIF-1β组合而成。在缺氧的环境下,HIF-1能够结合并激活许多哺乳动物细胞内涉及代谢调节、血管新生、胚胎发育、免疫和肿瘤等过程的特定基因。而在富氧环境中,这一蛋白又会被降解。
那么推动 HIF-1 破坏的原因是什么?答案来自一个意想不到的方向。
大约在Semenza和Ratcliffe探索EPO基因调控的同时,肿瘤学家William Kaelin 正在研究一种遗传综合征,即VHL 综合征,其特征是形成大量血管化肿瘤。这种遗传性疾病导致遗传VHL突变的家庭患某些癌症的风险显著增加。
Kaelin的研究表明VHL基因编码一种蛋白质,可以防止癌症的发生。缺乏功能性VHL基因的癌细胞表达异常高水平的低氧调控基因;但当VHL基因重新导入癌细胞时,正常水平得以恢复。这是一条重要线索,表明VHL在某种程度上参与了对缺氧反应的控制。后来,多个研究小组逐渐还原了整个过程——原来HIF-1α与VHL的结合需要氧原子的参与。在富氧的环境下,VHL 会结合 HIF-1α,并指导后者的泛素化降解。反之,在缺氧情况下,HIF-1α无法被降解。对这一氧感知信号通路的澄清也让Kaelin教授最终获得了诺贝尔奖。
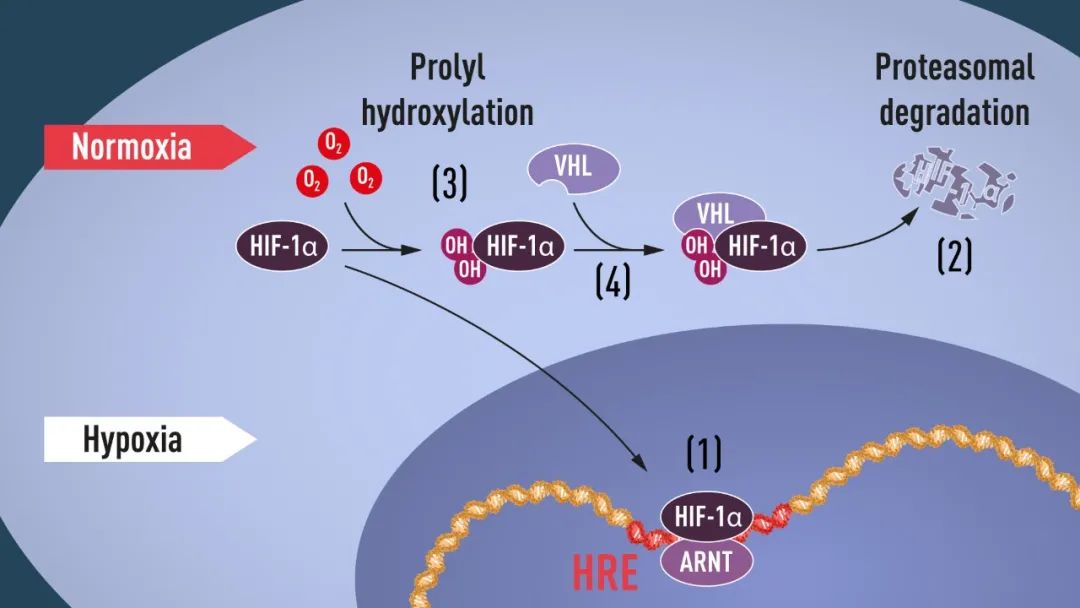
当氧气水平较低(缺氧)时,HIF-1α受到保护免于被降解,积聚在细胞核内,并与HIF-1β亚基又称芳香烃受体核转运子(ARNT)结合,并与低氧调控基因中的特定DNA序列(HRE)结合(1)。在正常氧气水平下,HIF-1α被蛋白酶体迅速降解(2)。氧气通过向HIF-1α添加羟基(OH)来调节降解过程(3)。VHL蛋白随后可识别并与HIF-1α形成复合物,导致其以氧依赖性方式降解(4)。(来源:诺奖官网)
不过,回到癌症治疗,Kaelin教授的团队发现缺乏VHL蛋白的细胞会积累高水平的HIF-1和HIF-2,而HIF的“失控”会有助于肿瘤生长,但这还没有被正式证明。所以在2002–2003年,他们又做了所谓的必要性和充分性实验,以真正确定HIF是否在VHL缺陷型肾癌中起到了因果作用。出乎意料的是,真正的罪魁祸首是HIF-2,而不是被研究得更多的HIF-1。这让HIF-2成为抗癌疗法开发的重要靶点。
当然,传统观点认为,由于HIF2是一种DNA结合转录因子,因此该靶点被认为是不可成药的。多年来,Kaelin教授团队一直希望能够对HIF所调控的分子(如VEGF)进行下游干预。这个策略取得了一定的成功。
更可喜的是,来自德克萨斯大学西南医学中心的Richard K. Bruick和Kevin H. Gardner博士带来了好消息——他们在HIF-2α蛋白上发现了一个可成药的“口袋”。基于这一研究而诞生的Peloton Therapeutics通过高通量筛选,最终发现了候选小分子疗法PT2385和PT2977,并且把它们推进到临床开发阶段。2019年,默沙东以约22亿美元收购Peloton,其中小分子HIF-2α抑制剂PT2977是Peloton吸引默沙东的一款核心在研产品,该候选产品即今年获得美国FDA批准的belzutifan。

PT2977作用机制(图片来源:Peloton公司官网)
而从最初发现编码HIF-2α到belzutifan上市,已过去了20多年。
Belzutifan和Roxadustat的未来
目前,Belzutifan已获批治疗肾细胞癌和VHL综合征。在Kaelin教授看来,在通过标准治疗失败的肾癌患者中,belzutifan的II期数据非常有希望,并且该药物已推进到III期。他认为肾癌的最终控制可能需要3–4种具有不同作用机制的药物的组合,并希望能够将belzutifan推向前线,最终与其它疗法联用以治疗肾细胞癌患者。
Kaelin教授还提到,关于联合用药有个基本原则,即需要相对特异、有效且能很好地协同作用的药物。Belzutifan比目前在肿瘤学中使用的许多激酶抑制剂更有针对性。因此,可能在组合疗法有所作为。
对于今年8月刚在在欧盟获得批准,但未在美国获批的另一款基于氧感知通路开发的药物——Fibrogen公司的roxadustat(HIF-PH抑制剂,通过稳定HIF来驱动红细胞生成),Kaelin教授表示,尽管有迹象表明,在接受治疗的患者中血栓形成轻微增加,尤其是那些血红蛋白纠正相对较快的患者。但如果开始时降低剂量,然后缓慢增加剂量,也许可以摆脱这种风险。包括日本和中国在内的许多国家的监管机构都看到了这些数据,并对收益大于风险感到满意。就美国而言,或许还有另一项研究。
氧感知领域的其他治疗机会
在HIF稳定剂方面,有可靠的临床前数据支持这些药物治疗缺血性疾病,如心脏病发作和中风。但这只是猜测。
而对于HIF2拮抗剂,科学家们已经研究了一点肾癌。还有一些其他肿瘤,例如副神经节瘤,是可以期待的。
还有一些有趣的数据(主要是在啮齿动物身上)表明HIF2抑制剂可能对肺动脉高压有帮助,或许可以预防肺动脉高压的发展。不过对于已经确诊的患者,其效果还不太清楚,也许已经太晚了。
对年轻科学家的建议
最后,Kaelin教授表示他非常幸运参与了一项发现并验证靶点的工作,但这不该是科学家们刻意为之的事。研究成果的转化是在充分理解了某件事,知道现在能做什么时自然发生的。
Kaelin教授还对年轻科学家选择研究重点给出了建议。他回忆起自己开始在David Livingston实验室研究RB1基因时,有20 000个基因可供研究,“所以为什么不研究一种在某些癌症中频繁突变的基因呢?因为这表明它至少对那些癌症很重要。”他表示:“遗传学验证过的靶点通常优于尚未被验证的靶点。”
参考资料:
1# The Nobel Prize-winning path from oxygen sensing research to newdrugs (来源:Nature Reviews Drug Discovery)
2# William G. Kaelin, MD, of Dana-Farber Cancer Institute wins 2019 Nobel Prize(来源:Dana-Farber Cancer Institute官网)
3# Press release: The Nobel Prize in Physiology or Medicine 2019(来源:诺贝尔奖官网)
4# 国际药讯 | FDA批准belzutifan用于VHL综合征相关的癌症(中国食品药品网)
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..