2021年7月,国家药监局、国家知识产权局发布了《药品专利纠纷早期解决机制实施办法(试行)》和《药品专利纠纷早期解决机制行政裁决办法》。
早在5月18日,国家药品监督管理局药品审评中心已正式发布《中国上市药品专利信息登记平台》并开启公开测试,待药品专利纠纷早期解决机制的办法实施后,测试期间已按要求登记的相关专利信息经药品上市许可持有人确认后公开,作为化学仿制药、中药同名同方药以及生物类似药申请人作出专利声明的依据信息。
在此,笔者梳理了我国专利发展情况、中美专利链接制度对比以及专利挑战相关案例,分享于此,供广大业内人士参考。
01
中国专利链接制度沿革
我国专利保护始于改革开放之后,早期的《专利法》明确将药品专利排除在专利保护范围之外,此后的几次修改均有不同程度的调整。
1992年《专利法》第一次修改,删除了原来有关药品、食品、饮料、调味品不授予专利权的规定,药品相关知识产权正式纳入《专利法》管理。
2020年《专利法》第四次修改,设置了上市药品的专利补偿期制度和专利链接制度等。多项规定相继面世,引发业界极大关注。
经过数月的讨论直至2021年7月5日左右,国家各部门密集出台了系列规定。至此,中国版的“药品专利链接制度”正式落地。下表是中国专利链接制度相关的重要法规。
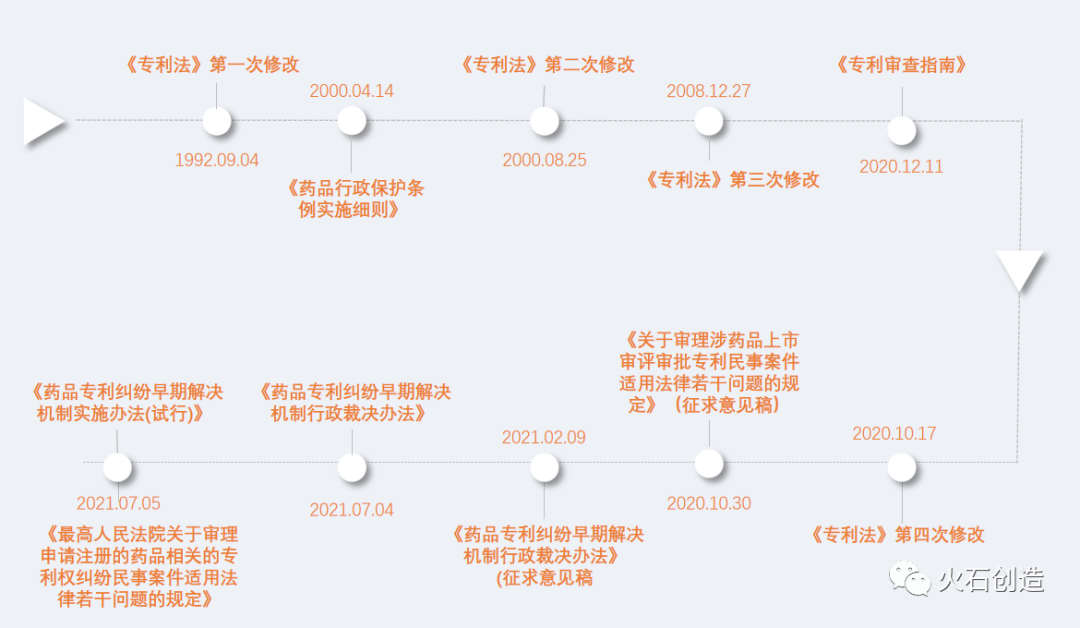
图1:中国专利链接制度发展脉络
来源:根据公开资料整理
02
中美专利链接制度对比
专利链接制度最早起源于美国1984年的《Hatch-Waxman法案》,该法案旨在平衡创新药公司和仿制药生产商之间的利益,在鼓励医疗创新的同时也通过加快仿制药上市而鼓励药品的价格竞争,有助于公众获取便宜的仿制药。
中国的链接制度框架很大程度上参考了该法案的内容,从表2的中美专利链接制度对比看,橙皮书制度、专利声明制度、遏制期制度、首仿药市场独占期制度等都已引入落地。
表2:中美专利链接制度差异
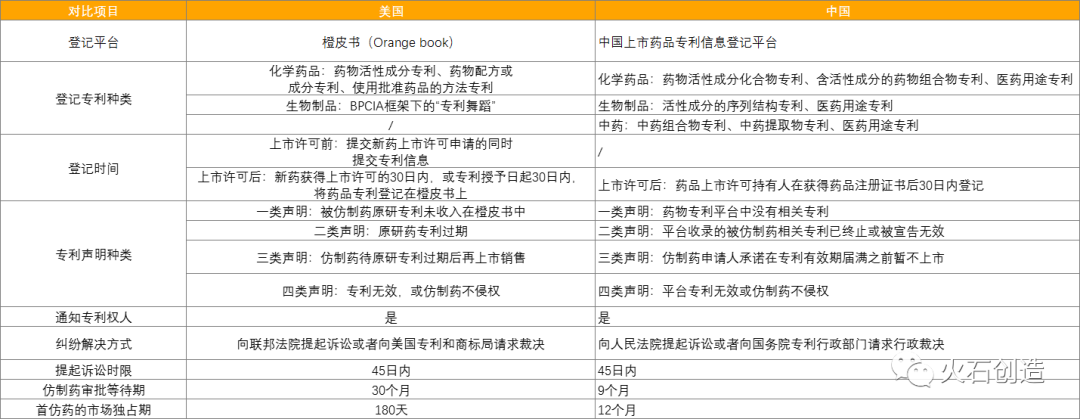
来源:根据公开资料整理
中美专利链接制度存在以下几处差异:
1) 仿制药审批等待期
美国FDA的仿制药审批等待期为30个月,如果任何一方没有合理配合诉讼过程造成延误,法院有权缩短或延长等待期。
而中国9个月的等待期还包含二审判决时间,对作出裁决来说存在较大的挑战。
2) 争议解决机构
在美国,对于第四类声明,专利权人/新药上市许可持有人可以在联邦地方法院对仿制药申请人提起专利侵权诉讼。在法院诉讼中,仿制药申请人既可以对专利有效性提出挑战,也可以对是否侵权提出异议。除此以外,仿制药申请人也可以在联邦法院民事诉讼开始之前或过程中,在美国专利和商标局(USPTO)请求对专利启动另外的复审程序,以此挑战专利的有效性。
在中国,专利权人/新药上市许可持有人向人民法院提起诉讼或者向国务院专利行政部门请求行政裁决。当事人对国务院专利行政部门作出的行政裁决不服的,可以在收到行政裁决书后依法向人民法院起诉。
3) 专利挑战市场独占期时长
美国独占期仅为180天,中国专利独占期则长达12个月。
03
专利挑战案例
2020年,大约18款跨国药企原研药品相关的24件专利遭遇中国制药企业或个人提出专利挑战,涉及国家知识产权局作出的26项决定号,全部无效决定占54%。
随着国内仿制药一致性评价和药品集中采购等政策的逐步推进,仿制药企业的竞争压力剧增。对于国内多数以仿制药开发为主业的制药公司来说,挑战跨国药企原研药品的专利,进而使其已获批准文号或者正在开发中的仿制药比预期更早推向市场比以前更加急迫,国家政策法规层面也对首仿药给与了很大的政策支持。
从笔者收集到的案例可以看出,近些年药品专利挑战的数量逐年增加,且包含很多重磅品种,例如仑伐替尼、替格瑞洛、沙库巴曲缬沙坦钠、托法替尼等。挑战专利较多的企业还是恒瑞、天晴、石药等头部药企,天晴一直是这其中的急先锋,目前将近20个品种首家过评,并且很多都是全球销售额达到几十亿的重磅品种。
表3:正大天晴药业在审的注册分类报产品种
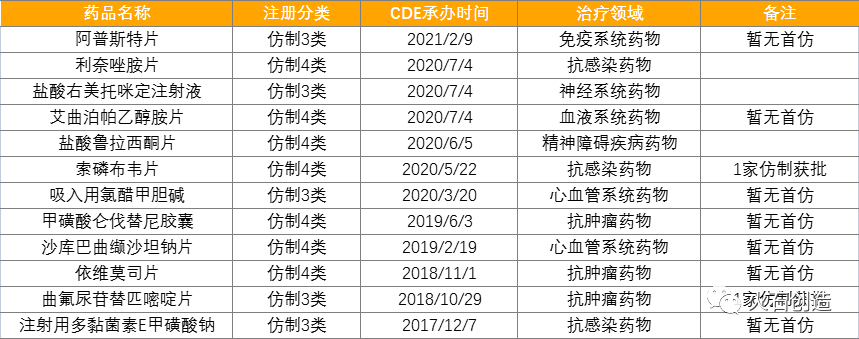
来源:根据公开资料整理
对于原研药物利挑战,一直是业内关注的焦点,下面简单介绍3款比较受关注药物的专利挑战案件。
1) 经典案例——伊马替尼(ZL01817895.2)
格列卫(Gleevec),化学名甲磺酸伊马替尼,《我不是药神》这部电影大家都很熟悉,里面贯穿整个电影的药物格列卫就是此药。甲磺酸伊马替尼是用于慢性髓性白血病治疗的一线用药,将患者的十年生存率从不足50%提高到了90%左右,被列为2001年世界十大科技突破之一的抗癌药,于2002年进入中国市场。
豪森及正大天晴在2013年伊马替尼化合物专利到期后分别开发了其他晶型并申报上市。2014年,诺华公司以豪森及正大天晴侵犯其伊马替尼治疗胃肠基质肿瘤的用途专利为由,向北京二中院提起专利侵权诉讼。正大天晴率先与诺华达成和解,豪森药业则坚持于2014年9月向专利复审委员会提起专利权无效宣告请求,专利复审委于2015年11月26日作出无效宣告请求审查决定,认为涉案专利不具有专利法第22条第3款规定的创造性,宣告该发明专利权全部无效。诺华公司不服向北京知识产权法院上诉,最后判决:驳回上诉,维持专利复审委决定。诺华公司不服判决,又向北京高院上诉,在2017年12月20日北京高院判决:驳回上诉,维持原判。
就这样豪森和诺华就抗癌药格列卫长达4年的专利之战以豪森获胜而结束。
2) 经典案例——沙库巴曲缬沙坦钠(ZL 201110029600.7)
诺华公司开发的诺欣妥(沙库巴曲缬沙坦钠片,Entresto)是心衰领域的重磅炸弹产品。
方生和医药法律顾问戴锦良律师在2017年4月对Entresto 组合物核心专利发起挑战并获得成功,宣告专利权全部无效。该案件还被国家知识产权局专利局评为2017年度专利复审无效十大案件之一。
2019年以来,石药集团欧意药业、齐鲁制药、北京四环制药、山东新时代药业、正大天晴药业、华润三九医药、深圳信立泰药业等国内药企对Entresto提出专利无效挑战,已经/或者即将进行口审,涉及到沙库巴曲缬沙坦钠片关键性的2项化合物和组合物专利(ZL 200680001733.0,ZL 201210191052.2)。7月2日,国家知识产权局网站公布3项专利无效决定,认定信立泰、石药集团欧意药业、南京正大天晴对Entresto核心专利发起挑战的结果是“专利部分无效”,专利人上诉到国家知识产权法院,而最高人民法院维持了原审判决,宣告Entresto的组合物专利在中国已经被攻破。
3) 经典案例——奥氮平口崩片(ZL91103346.7)
礼来和华生两家药企为抗抑郁药物争讼十多年,是关于专利挑战持续最久的案例。
礼来公司曾在2002-2011年握有奥氮平制备方法中国专利,2003年9月礼来向南京中院起诉华生制药侵害其奥氮平的发明专利权(涉案专利CN91103346.7),法院以华生制药举证不能为由认定礼来公司的侵权指控成立,经二审判决华生公司停止侵权并赔偿礼来公司50万元;2008年南京中院一审认定华生公司不侵权,2010年6月21日常州华生制药有限公司对涉案专利 CN91103346.7提出无效请求,但最终判定维持专利有效;2011年,江苏省高级法院二审改判华生公司侵权,基于此判决,2013年礼来提起赔偿诉讼,请求法院判决华生公司停止侵权。礼来公司、常州华生制药有限公司均不服一审判决,向最高人民法院提起上诉。2015年,最高法院开庭审理索赔案改判华生公司不侵权。2016年6月16日,最高人民法院经过审理判决撤销一审判决,驳回礼来公司诉讼请求。礼来申请再审,但最高法院2017年裁定不予再审,2018江苏省高院针对是否应依职权启动再审进行了复查谈话,但针对此前结果至今未有变化。
04
小结
经过数十年的发展,我国专利制度渐近完善和成熟。随着药品专利链接制度的落地及实施,预计药品专利挑战事件快速增长。
从药品专利保护角度来看,原研公司往往通过化合物、盐型、晶型、合成路线、制剂、用途等对药品进行专利网布局,全面建立专利壁垒。对于原研药企业而言,重中之重在于积极申请专利,完善专利布局;对于仿制药企业而言,则可以在充分了解和善用国家的法律、政策、法规的基础上,长期和实时追踪相关专利的状态,适时、有策略地发起专利挑战。
中国药品专利链接制度将带来巨大的市场变革,无论是原研药企业还是仿制药企业,都应当充分研究了解这一新的制度,利用药品专利链接制度争取有利的市场地位。
协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..