6月2日,Synexis公司宣布FDA批准Brexafemme(ibrexafungerp)每日1次片剂上市,用于治疗阴道酵母菌感染。ibrexafungerp是全球首个获批用于阴道酵母菌感染的口服非唑类药物,是女性健康领域抗真菌感染的重大突破,也是20多年来首个获批的全新作用机制的第四代抗真菌类药物。
全球约70%-75%的女性一生中至少经历一次阴道酵母菌感染,该领域自1990年起无创新疗法。阴道酵母菌感染临床表现为外阴瘙痒、灼痛等,严重影响生活质量。目前常见疗法为局部外用或口服唑类抗真菌药,临床应用受限,抗真菌药耐药性持续上升,因此患者需要更加安全有效的抗真菌创新疗法,临床医疗需求迫切。截至目前,唑类是唯一一类在美国获批用于阴道酵母菌感染治疗的药物。
Ibrexafungerp可抑制葡聚糖合成酶,属于first in class的三萜类抗真菌剂。与唑类药物的抑制真菌的作用机制不同,Ibrexafungerp可杀死真菌细胞,因此被认为是全新类别的广谱抗真菌药物。
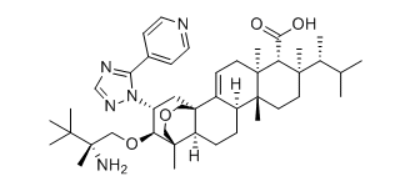
Ibrexafungerp结构式
FDA此次批准Ibrexafungerp主要基于两项多中心、随机、双盲、安慰剂对照、III期VANISH-303研究和VANISH-306研究的积极结果,口服ibrexafungerp相比安慰剂显著提高了临床治愈率,并对外阴阴道念珠菌病女性患者显示出良好的耐受性。
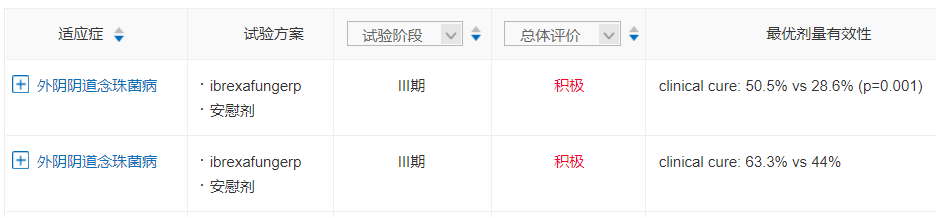
念珠菌阴道感染是ibrexafungerp获得FDA批准的第一个适应症,其他在开发的适应证还包括住院患者的危及生命的真菌感染,比如侵袭性念珠菌病。
今年2月17日,豪森药业与Scynexis签订战略合作协议,获得ibrexafungerp在大中华区(包括香港、澳门及台湾)开发和商业化的独家权益,为此向Scynexis支付1000万美元首付款,后续还需支付潜在的里程金及销售提成。豪森药业目前正在国内推进ibrexafungerp的关键注册性临床试验,并进行多个潜在适应症的开发。
BD交易是豪森近两年布局创新药业务的主要手段之一,走一条license in/out相结合的路线,先后与EQRx、Viela Bio、Atomwise、NiKang Therapeutics、拓臻生物、Scynexis达成签订合作协议。
关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..