EU GMP 附录1《无菌产品生产》2020版已于2月20日发布,此次的无菌附录,对于之前的一些无菌的要求进行了修订,更加细致和严谨,并且首次明确提出了对于无菌产品的CCS评估的要求。基于国内外无菌产品生产规范指南以及ICH Q9质量风险管理,全方位梳理无菌产品污染关键风险,推动无菌产品污染控制策略的可行可控。
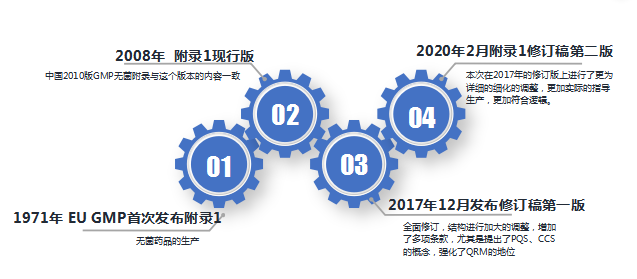
(1)EU GMP附录1修订历史
(2)CCS定义
Contamination Control Strategy (CCS) – A planned set of controls for microorganisms, pyrogens and particulates, derived from current product and process understanding that assures process performance and product quality. The controls can include parameters and attributes related to active substance, excipient and drug product materials and components, facility and equipment operating conditions, in-process controls, finished product specifications, and the associated methods and frequency of monitoring and control.
污染控制策略(CCS):对微生物,热原和微粒的一系列计划内控制方法,源于对当前产品和工艺的理解,可确保工艺性能和产品质量。
控制可以包括原料,辅料和药品的材料和成分,设施和设备的运行条件,过程控制,成品标准以及相关的监控方法和频率有关的参数和属性。
(3)CCS目的
Quality Assurance is particularly important, and manufacture of sterile products must strictly follow carefully established and validated methods of manufacture and control. A Contamination Control Strategy (CCS) should be implemented across the facility in order to define all critical control points and assess the effectiveness of all the controls (design, procedural, technical and organisational) and monitoring measures employed to manage risks associated with contamination. The CCS should be actively updated and should drive continuous improvement of the manufacturing and control methods.
质量保证尤为重要,无菌产品的生产必须严格遵循精心建立,并经过验证的生产和控制方法。
污染控制策略(CCS)应在整个厂房设施内得到实施以确定出所有关键点并评估用于管理污染相关风险的所有控制方式(设计,规程上的,技术和组织层面)和监测措施的有效性。
应积极更新 CCS,CCS 应促使生产和控制方法的持续改进。
(4)CCS的具体实施
The development of the CCS requires thorough technical and process knowledge. Potential sources of contamination are attributable to microbial and cellular debris (e.g. pyrogen, endotoxins) as well as particulate matter (e.g. glass and other visible and sub-visible particulates). Elements to be considered within a documented CCS should include (but are not limited to):
CCS 开发需要全面的技术和工艺知识。潜在的污染源源于微生物及细胞残骸(例如热原/内毒素)以及颗粒(例如玻璃及其他可见和不可见微粒)。文件化的污染控制策略应考虑的要素包含(但不限于):
i. Design of both the plant and processes. 厂房和工艺的设计
ii. Premises and equipment. 厂房设施和设备
iv. Personnel. 人员
v. Utilities. 公用系统
vi. Raw material controls – including in-process controls. 起始物料的控制-包含中间控制
vii. Product containers and closures. 产品包装
viii. Vendor approval – such as key component suppliers, sterilization of components and single use systems (SUS), and services. 供应商的批准-例如关键组分的供应商、部件的灭菌及一次性使用系统(SUS)和服务。
ix. For outsourced services, such as sterilization, sufficient evidence should be provided to the contract giver to ensure the process is operating correctly. 对于委托外部的服务,例如灭菌,应将充分的证据提供给合同的委托方,以确保工艺的正确操作。
x. Process risk assessment. 工艺风险评估
xi. Process validation. 工艺验证
xii. Preventative maintenance – maintaining equipment, utilities and premises (planned and unplanned maintenance) to a standard that will not add significant risk of contamination.
预防性维护保养-设备,公用系统及设施的维护保养(计划性及非计划性维护保养)符合标准,不会加大显著的污染风险
xiii. Cleaning and disinfection. 清洁和消毒
xiv. Monitoring systems - including an assessment of the feasibility of the introduction of scientifically sound, modern methods that optimize the detection of environmental contamination. 监测系统-包括对引入检测方法的可行性评估,方法科学合理,现代化,能够优化环境污染的检测。
xv. Prevention – trending, investigation, corrective and preventive actions (CAPA), root cause determination and the need for more comprehensive investigational tools. 预防措施-趋势分析、调查、纠正和预防措施(CAPA)、根本原因的确定以及需求更全面的调查工具
xvi. Continuous improvement based on information derived from the above.
基于来自上述衍生信息的持续改进。
(4)无菌生产中设备管理
无菌产品的生产应符合特定要求,以减少来自微生物, 颗粒及热原方面的污染风险, 应考虑到以下关键区域:
厂房设施,设备及工艺设计应根据良好药品生产管理规范(GMP)相关附录中的要求进行优化,确认和验证。应考虑采用适当技术手段(例如,限制进入屏障系统(RABS),隔离器,机器人系统,快速微生物测试和监测系统)以加强从潜在外来微粒和微生物污染(例如人员,物料及周边环境)中对产品进行保护,并实现对环境和产品中的潜在污染的快速识别。
用于无菌产品生产的洁净室和空气净化设备例如单向气流单元(UDAFs)、 RABS 和隔离器, 应根据环境要求进行确认和定级。各生产操作在操作状态下都要求合适的环境洁度,以尽可能降低因处理产品或物料而产生的颗粒或微生物污染风险。
称量设备
关注点(input):粉末物料的扩散造成交叉污染;液体称量设备、器具的交叉污染
应考虑的策略(output) :采用负压称量技术,使称量区域的始终保持相对负压状态;在配制区外设置气锁室,减少粉尘对其他区域的污染。毒性较大的物料单独设立称量室或者采用隔离舱。制定可靠的程序进行液体物料称量设备、器具的清洁操作。
配制设备
关注点(input):进入配液罐的空气如何处理?配液罐物料进入系统是否开口?开口投料如何保护?
应考虑的策略(output) :配制罐应设置疏水性除菌过滤器,并考虑过滤器的灭菌和完整性测试。使用密闭的物料输送系统;配制时,可采用单向流装置保护配液罐的开口操作区域。
过滤设备
关注点(input):除菌过滤系统如何设计?过滤前的物料微生物负载情况?完整性测试的方法、时机,浸润液的去除?
应考虑的策略(output) :选择适合的过滤器材质,确认除菌过滤器与料液的相容性,既不吸附料液中的化学物质,也不释放污染物到料液中。应确认过滤器对微生物的拦截能力。
为降低因过滤器完整性问题造成的除菌失败,建议串联两个过滤器。
结合工艺情况,选择适合的完整性测试方法、时机,及后续的清洗。
如使用异丙醇等非工艺液体进行浸润的,应考虑如何去除。
清洗设备
关注点(input):如何去除内包材的化学物质、微生物、内毒素、微粒?
应考虑的策略(output):通过洗瓶机(胶塞清洗机)来去除外来化学物质和微粒,并有效的降低微生物负荷。清洗程序应经过确认,应关注洗瓶时WFI温度、压力以及压缩空气的压力不稳定带来的风险。通过隧道烘箱的干热灭菌来去除微生物和热源(内毒素)。每种装载均应进行相关确认。应关注高温段与低温段之间的压差以防影响高温段的空气的温度;应关注灌装间与洗瓶间之间的压差,以防低级别区域的空气污染高级别区域的空气。
物料转移设备
关注点(input):如何进行灭菌后胶塞的无菌转移?转移过程中的对接、保护等设计。

灌装设备
关注点(input):如何降低操作人员对无菌产品、无菌包材的污染?(装配、取样操作等人员干预)灌装设备是否存在不易清洁部位和死角?
应考虑的策略(output) :灌装暴露区采用RABS(限制进出隔离系统)或隔离器技术,尽可能的降低操作人员对无菌产品、无菌包材的污染。关键区的设计应有助于实现最佳单向流模式。
灌装机的设计应易于清洁,没有积累化学和生物污染的裂缝或死角,应尽可能的避免使用螺纹接头。
冻干设备
关注点(input):在灌装后半压塞状态下,如何将产品转移到冻干设备中?在冻干后半压塞状态下,如何将产品转移到扎盖设备中?
应考虑的策略(output) :尽量减少人员干预操作,绝对避免人员接触制品开口部位,将操作者和高风险区域隔离开来。可采用RABS系统下的输送带形式将产品转移至冻干机或扎盖机中。改进冻干机的进出料方式,采用自动进出料系统。
设备维修、维保过程
维修人员引入的污染,更衣程序控制、模拟灌装的参与
维修过程引入:维护工具的传递、传动设备润滑油的使用
电气控制柜的布局,动力部件是否暴露在无菌环境中,如何进行润滑维护?
本文来源于允咨GMP制药技术。由“制药业”平台整理发布,转载请注明出处。欢迎关注“制药业”公众号,获得最新制药业创新技术、新闻动态等热点话题。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..