Trodelvy是FDA批准的第一个专门治疗复发或难治性mTNBC的ADC药物,也是FDA批准的第一个抗Trop2 ADC药物。靶向Trop2的成功,正在吸引国内外的开发者进入该领域。
疾病控制率达95%!
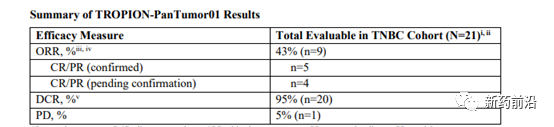
在近日2021年欧洲医学肿瘤内科学会(ESMO)乳腺癌年会(虚拟会议)上,第一三共和阿斯利康(AZ)报告了其合作开发的靶向肿瘤相关蛋白TROP2的抗体药物偶联物(ADC)datopotamab deruxtecan(Dato-DXd)在标准治疗后转移性三阴性乳腺癌(TNBC)患者疾病进展的临床反应和疾病控制结果。

经盲法独立中心审查评估,21例接受datopotamab deruxtecan治疗的患者(6mg/kg (n=19)或8mg/kg (n-2))的初步客观反应率(ORR)为43%。在2021年1月8日数据截止时,观察到5例已确认的完全或部分缓解(CR/PR),还有4例正在等待确认CR/PR。疾病控制率(DCR)达到95%。
TNBC约占乳腺癌病例的10%至15%,与其他乳腺癌亚型相比,其疾病复发率更高,预后更差。据估计,转移性TNBC患者中只有12.2%可以存活5年,中位总生存期通常少于两年。
大约一年前,阿斯利康同意在两年内先付10亿美元以获得该药在日本以外的权益,外加50亿美元的里程碑付款。
datopotamab deruxtecan结合了靶向TROP2的抗体,该抗体使用稳定的接头与有效的拓扑异构酶I抑制剂(DXd)有效载荷偶联。第一三共认为该药具有较低的药物/抗体比例,既可以增强细胞杀伤活性,又可以限制副作用(datopotamab deruxtecan由第一三共采用其DXd抗体偶联技术平台设计提供了灵活性,以适应药物与抗体之比(DAR)或每个抗体结合的DXd分子数)。
阿斯利康以69亿美元收购第一三共的Enhertu(曲妥珠单抗deruxtecan)的交易于2019年成功完成。Enhertu已被批准用于先前治疗过HER2阳性乳腺癌和胃癌患者。datopotamab deruxtecan不会以该适应症为目标。
不过公布的数据仍处于早期阶段,仅处于Ⅰ期阶段,只有21名患者,第一三共强调,药物的效果如何?以及在更大患者群体中将有多安全?还有很长的路要走。
第一三共的未来试验将寻求评估datopotamab deruxtecan生存潜力,这是获得批准所需的关键数据,但该公司从目前的数据中看到了对其前景充满乐观的理由。
直接PK谁更具优势?
1
疗效
主要竞争对手——吉利德/Immunomedics靶向于TROP-2受体的抗体和拓扑异构酶抑制剂ADC药物Trodelvy(sacituzumab govitecan-hziy)已获得FDA批准用于TNBC。
交叉试验比较是不可避免的:Trodelvy在三线或以上TNBC中的标签在单队列Imu-132-01研究中ORR为33%,而对照试验Ascent平均总生存期为11.8个月,单独化疗组为4.9个月(p < 0.0001)。
datopotamab deruxtecan和Trodelvy作用机制相似,均以Trop2抗原为靶点。两者都是ADC,使用SN38载荷的Trodelvy和拓扑异构酶I抑制剂datopotamab DXd。datopotamab DXd与Enhertu中使用的有毒有效载荷相同。
除了TNBC外,Trodelvy还被加速批准用于尿路上皮膀胱癌,而datopotamab deruxtecan还正在肺癌适应症的研究。
投资者还将重点放在Trodelvy的Ⅲ期Tropics-02研究中,该药物在三线Her2阴性但HR阳性的乳腺癌患者中进行了测试,这是一个重要的适应症扩展方法。
重要的是,Tropics-02指定患者必须使至少一种CDK4/6抑制剂失效,即Ibrance,Kisqali或Verzenio。早期Ⅰ期数据表明,Trodelvy在CDK4/6治疗后患者的总体生存期仅为11个月左右,而之前未进行CDK4/6治疗的患者则为22个月。Tropics-02的结果将在下半年公布。
2
安全性
在安全方面,业界一直存在datopotamab deruxtecan有关的间质性肺病的担忧,分析家指出,在较早的试验中已经发现这种副作用。尽管公司并没有确认,但显然需要进一步的试验才能找到答案。
尽管由于不良事件确实有六名患者不得不减少剂量,但datopotamab deruxtecan发现严重腹泻的情况少于使用其技术制备药物。datopotamab deruxtecan最常见副作用口腔炎(13%)和粘膜炎症(8%)。33%的患者发生了3级或更高级的紧急不良事件。总的来说,最常见的不良事件是口腔炎,恶心,疲劳,呕吐和脱发。但是,没有因为不良事件而脱落。
datopotamab deruxtecan在NSCLC试验中也发现了相对较高的口腔炎发病率。
Trodelvy具有中性粒细胞减少和腹泻的包装警告,而Ascent试验中则显示口腔炎发生率为17%。
国内Trop2追逐者
今年3月4日,百奥泰宣布终止处于Ⅱ期阶段ADC药物BAT8003(注射用重组人源化抗Trop2单克隆抗体-美登素偶联物),据悉是因美登素为原料的有效载荷中遇到了问题。值得一提的是,辉瑞于2016年也放弃了其抗Trop2 ACD药物PF-06664178的开发。
不过,国内还有2家企业独自开发的Trop2项目正在临床试验中,分别为:科伦的SKB264和上海君实生物的JS108。
1
科伦
SKB264是科伦药业控股子公司四川科伦博泰生物医药股份有限公司开发的TROP-2的ADC,其通过新型偶联方式实现高毒素负载,非临床研究数据表明在TROP-2阳性的乳腺癌、胃癌、肺癌和结直肠癌动物模型中的抗肿瘤活性显著,兼具良好的安全性和耐受性。
SKB264于2019年8月23日获得美国FDA批准开展临床试验,2020年获得国家药监局临床试验通知书,是继注射用A166后,第二个实现中美双报的创新ADC药物。
2
君实
2019年12月,君实生物以3000万元预付款+2.7亿元里程碑金额的价格获得了多禧生物DAC-002在日本、韩国外亚洲国家的权益。DAC-002是注射用重组人源化抗Trop2单抗-Tub196偶联剂。
2020年7月,君实生物的JS108(DAC-002)获得国家药品监督管理局核准签发的《药物临床试验批准通知书》,同意其开展治疗晚期实体恶性肿瘤的临床试验。
JS108主要用于治疗Trop2阳性三阴性乳腺癌、小细胞肺癌、胰腺癌等实体肿瘤。
值得一提的是,云顶新耀在 2019 年以 8.35 亿美元获得了 Trodelvy 大中华区、韩国及部分东南亚国家的独家权益。该药(注射用戈沙妥组单抗)在国内的上市申请于5月12日获CDE受理。
新药前沿
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..