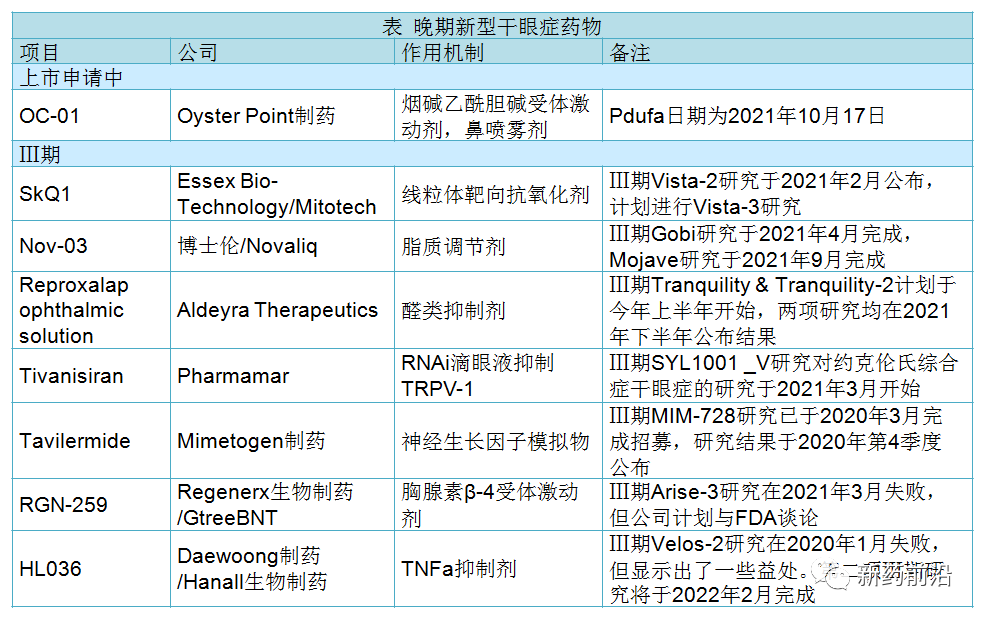
尽管目前全球已多种用于治疗干眼症的产品获得批准上市,但该疾病仍未得到满足。干眼症新药晚期赛道相对拥挤,并有多种不同机制的药物正在进行试验。
又有一种药物试验取得成功
4月13日,博士伦医疗公司(Bausch Health Companies)的NOV03(全氟己基辛烷),在其Ⅲ期Gobi试验中取得成功。
NOV03是由德国Novaliq公司基于全球首个无水药物递送技术平台EyeSol开发的药物,通过在眼表面形成稳定包膜、防止泪液过强蒸发,治疗与睑板腺功能障碍相关蒸发过强型干眼症。该项技术可提高传统水不溶性或不稳定药物的溶解度和稳定性,从而使滴眼液具有更好的溶解性、稳定性、生物利用度、安全性和舒适性。Novaliq公司在欧洲已将NOV03以商品名Evotears推向市场销售。
2019年12月20日,博士伦宣布与Novaliq公司达成协议,获得NOV03在美国和加拿大的商业化开发独家许可。而在2019年11月7日,恒瑞曾以1.65亿美元从Novaliq公司引进2种干眼症新药在中国的临床开发、生产和市场销售的独家权益,其中就包括NOV03(SHR8058)。
尽管NOV03临床试验获得成功,但想要获得监管机构FDA批准并非易事。Kala制药公司开发的Eysuvis(loteprednol etabonate)在去年进行了三项关键性试验之后才最终获得批准。Eysuvis的一项初步研究表明,该药对干眼症的体征有益,但对症状却无济于事,这促使FDA要求Kala制药公司提供第三项试验的数据。
对于NOV03来说,这是一个积极的信号,Gobi试验同时获得了体征和症状结果。在体征上,在57天时,NOV03与生理盐水相比,总的角膜荧光素染色有统计学上的显著降低,这是一种眼损伤的检测标准。在症状方面,与生理盐水相比,NOV03的干燥评分在57天时有统计学上的显著下降。
尽管目前市场上已经有诸如艾伯维的Restasis(cyclosporin,环孢素)和诺华的Xiidra(lifitegrast)之类的经批准的干眼症产品,业界分析师对NOV03未来的竞争机会更为乐观,主要是全氟己基辛烷在改善眼睛中睑板腺的独特功能,通过增强睑板腺的分泌功能有助于保持眼睛湿润,睑板腺功能障碍是大多数干眼症的原因。
还有市场空间
干眼症的治疗仍有改善的空间。Restasis和Xiidra之类的药物无法使患者完全缓解,并且由于当前疗法的不足,干眼症患者中接受治疗的比例很低。
尽管有不足之处,但据医药市场调研机构Evaluate Pharma预测,Xiidra在2026年仍将实现6.88亿美元的收入,这也是2019年诺华出资34亿美元从日本武田制药手中收购该药的主要原因。
而且,多家制药公司仍在努力开发新药以解决干眼症问题。
Oyster Point制药公司将戒烟药物Chantix(varenicline,伐尼克兰)重新配制为鼻喷雾剂OC-01治疗干眼症。在去年公布了积极的关键数据之后,该公司预计将在今年10月获得监管机构批准决定。
促炎症的活性醛类可能导致眼部炎症。Aldeyra的reproxalap旨在通过降低醛的含量来减少炎症发生,进而缓解眼痒。Tranquility和Tranquility-2的Ⅲ期临床试验正在对干眼症进行研究,该试验将在下半年公布结果。Evaluate Pharma预测2026年reproxalap的销售额为3.91亿美元。
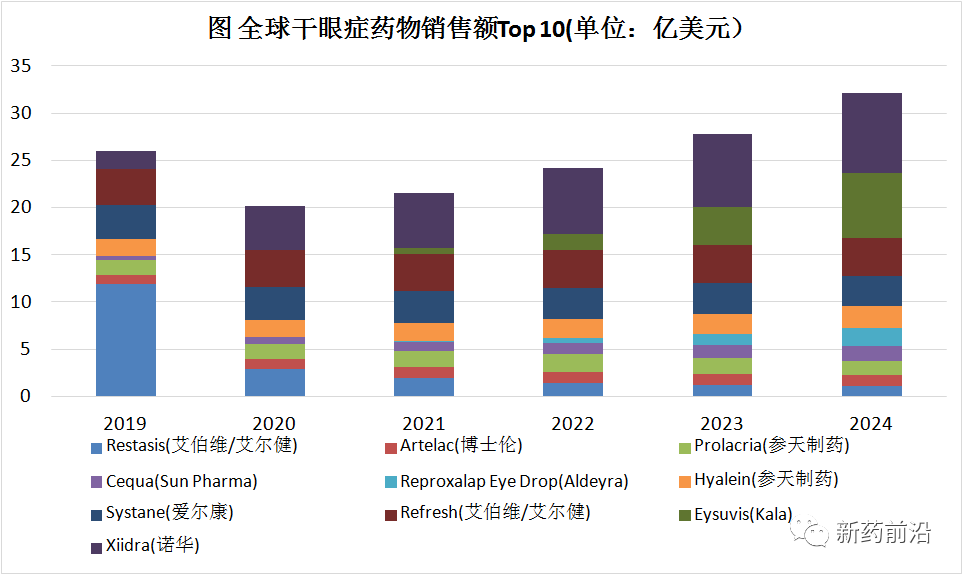
总之,在干眼症领域,需要多种不同的机制来解决这个未满足需求的市场。而在全球市场,Xiidra(诺华)、Eysuvis(Kala)和Refresh(艾伯维/艾尔健)无疑是干眼症领域最具潜力品种,到2024年销售额分别为8.44亿美元、6.92亿美元和4.04亿美元,位列前三名。而Restasis(艾伯维/艾尔健)随着专利到期后仿制药侵蚀销售额从重磅炸弹级别急剧下滑到2024年1亿美元左右。
四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..