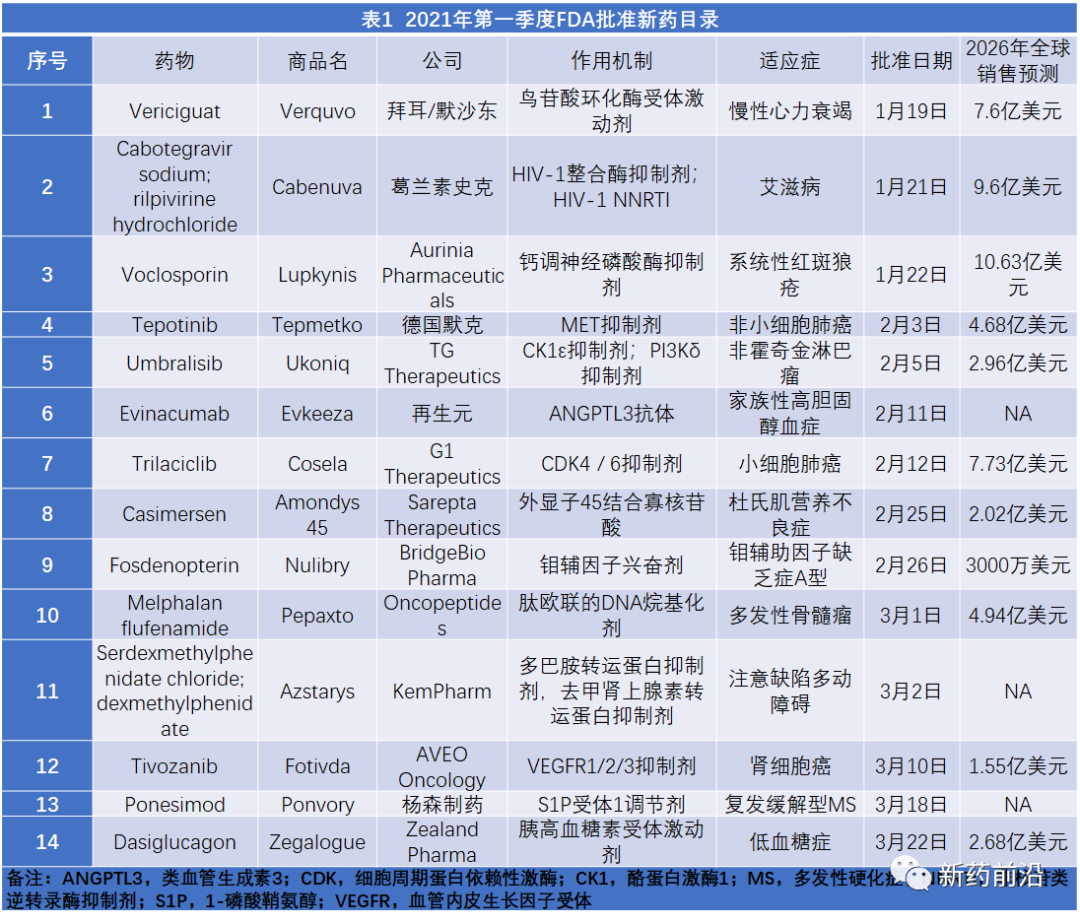
在2021年第一季度,FDA批准了14种新药。这一总数超过了去年同期12项批准记录,远远超过了2019年第一季度的7项批准。
肿瘤领域
肿瘤产品继续占据主导地位,获得了FDA的5项批准。其中,G1 Therapeutics公司开发的CDK4/6抑制剂Cosela(trilaciclib)值得关注,因为该药被批准减轻化学疗法的副作用(降低广泛期小细胞肺癌患者在接受某些类型化疗时出现的骨髓抑制频率),这是第一种获批用于该用途的CDK4/6抑制剂。德国默克公司(Merck KGaA)的Tepmetko(tepotinib)获批用于具有MET外显子14跳跃突变的转移性非小细胞肺癌成人患者,将与诺华的MET抑制剂Tabrecta(capmatinib)进行竞争,Tabrecta具有比Tepmetko领先9个月获得FDA批准的优势,但Tepmetko每日一次给药与Tabrecta每日两次给药相比,更具便利性可能会支持Tepmetko市场份额的增长。
AVEO Oncology的VEGFR抑制剂Fotivda(tivozanib)是市场上可能面临最大挑战的一种抗癌药物,经过5年的努力,该药物终于获得FDA批准。然而,肾细胞癌领域发生了巨大变化,目前抗PD1/PDL1药物与其他产品的联合正在主导该适应症的治疗。Fotivda预计在2026年的销售额将仅为1.55亿美元也就不难理解了。
其他竞争激烈领域
在第一季度获得批准的其他面对强大的现有市场竞争对手的产品还包括杨森的用于多发性硬化症的S1P受体调节剂Ponvory(ponesimod)。该药物面临的竞争不仅来自同一药物类别的百时美施贵宝的Zeposia(ozanimod)和诺华的Gilenya(芬戈莫德),还有罗氏的抗CD20 单克隆抗体Ocrevus(ocrelizumab)。去年,Ocrevus的销售额增长了24%,达到46亿美元。鸟苷酸环化酶激动剂Verquvo(vericiguat)获批用于治疗射血分数降低的有症状慢性心力衰竭患者,也将进入激烈的竞争格局,诺华的Entresto(沙库巴曲缬沙坦)已成为治疗标准,阿斯利康的Farxiga(达格列净)在今年初也获得该适应症的批准。
唯一重磅炸弹潜质药
Aurinia Pharmaceuticals的钙调神经磷酸酶抑制剂Lupkynis(voclosporin)是本季度批准的唯一一种有望在上市后5年内实现重磅炸弹级别销售额的产品。Lupkynis是治疗狼疮性肾炎的首个口服疗法,可以使其与葛兰素史克的皮下注射剂型单抗Benlysta(belimumab)错位竞争,从而引起业界对Aurinia可能会成为大型制药企业收购目标的猜测。
罕见病领域
罕见病获得了3项批准。Sarepta获得了针对杜氏肌营养不良症(DMD)的第三项批准,该产品是根据治疗48周后肌营养不良蛋白相对于基线水平的增加而获得批准的,但是,与Sarepta用于其他DMD患者亚群的类似产品一样,目前尚缺乏明确的证据表明肌营养不良蛋白的产生可带来临床益处。其他两种批准的药物是first-in-class:纯合子家族性高胆固醇血症治疗药物Evkeeza(evinacumab)和遗传性代谢异常A型钼辅因子缺乏症治疗药物Nulibry(fosdenopterin)。
尽管第一季度FDA批准具有潜在的重磅炸弹销售额产品寥寥,但至少代表着今年批准新药一个良好的开端。由于COVID-19对FDA工作的影响可能会减弱,因此,如果继续保持这种步伐,2021年FDA批准新药数量可能会再次打破纪录。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..