今日,武田(Takeda)宣布,美国FDA已经授予其在研疗法mobocertinib(TAK-788)的新药申请优先审评资格,用于治疗EGFR外显子20插入阳性的转移性非小细胞肺癌(NSCLC)成人患者。这些患者此前接受过含铂化疗。新闻稿指出,mobocertinib是首个专门为选择性靶向EGFR外显子20插入而设计的口服疗法。
非小细胞肺癌是最常见的一种肺癌,据世界卫生组织统计,约占全球每年新诊断肺癌病例的85%。EGFR外显子20插入阳性的转移性NSCLC患者约占NSCLC患者的1-2%,该疾病在亚洲人群中更常见。这类患者比其他EGFR突变的预后更差。目前还没有针对这一基因变异的获批靶向疗法,现有的EGFR酪氨酸激酶抑制剂和化疗为这些患者提供的益处有限。
Mobocertinib是一种专门设计用于选择性靶向EGFR外显子20插入突变的强效口服小分子酪氨酸激酶抑制剂。它在2020年4月获得FDA授予的突破性疗法认定,用于治疗含铂化疗期间或之后疾病进展的EGFR外显子20插入阳性转移性NSCLC患者。2020年10月,mobocertinib在中国被药品审评中心(CDE)指定为突破性治疗产品。
优先审评资格的授予是基于1/2期临床试验的结果,此前公布的结果显示,在114名患者中,根据独立数据监控中心的评估,mobocertinib达到28%的确认客观缓解率,中位缓解持续时间为17.5个月,疾病控制率达到78%。
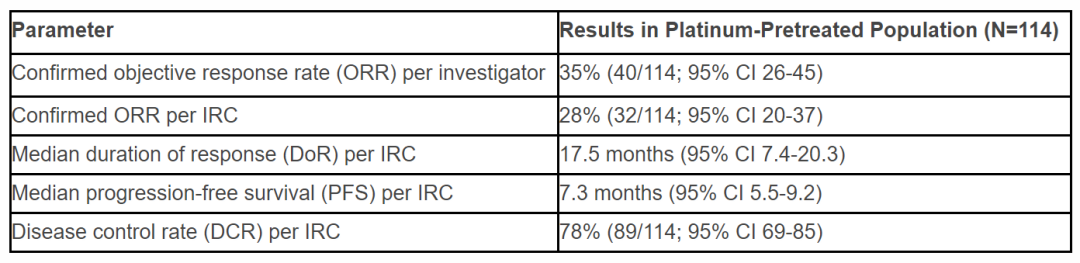
▲Mobocertinib的1/2期临床试验结果(图片来源:参考资料[2])
“EGFR外显子20插入阳性NSCLC患者面临相当大的挑战,因为目前治疗选择提供的获益有限,导致生存结局较差,”武田肿瘤治疗领域负责人Christopher Arendt博士说,“我们很高兴能向这些患者提供mobocertinib的目标又近了一步,并期待与美国和全球的监管机构继续对话。”
参考资料:
[1] Takeda Announces U.S. FDA Grants Priority Review for New Drug Application for Mobocertinib (TAK-788) as a Treatment for EGFR Exon20 Insertion+ Metastatic Non-Small Cell Lung Cancer. Retrieved April 27, 2021, from https://www.businesswire.com/news/home/20210427006162/en
[w] Takeda Presents Positive Results For Mobocertinib in Patients with EGFR Exon20 insertion+ mNSCLC Who Received Prior Platinum-based Chemotherapy. Retrieved January 28, 2021, from https://www.businesswire.com/news/home/20210128005072/en
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..