今日,日本大鹏药品(Taiho Pharmaceutical)和旗下Taiho Oncology宣布,美国FDA已经授予不可逆FGFR口服抑制剂futibatinib(TAS-120)突破性疗法认定,用于治疗经治局部晚期或转移性胆管癌(cholangiocarcinoma)患者。这些患者携带FGFR2基因重排或融合。突破性疗法认定旨在加快治疗严重或危及生命的创新疗法的开发和审评过程。
胆管癌包括肝内胆管癌和肝外胆管癌,它通常在老年人中出现。目前对胆管癌的主要疗法是手术切除,然而胆管癌早期没有明显症状,多数患者在确诊时已失去手术时机。局部晚期和转移性胆管癌无法通过手术完全切除,目前的标准治疗选择主要为化疗、放疗、肝移植,患者预后不良。肝内胆管癌的5年生存率只有9%,而且在亚洲人群中发病率更高。去年,FDA加速批准Incyte公司开发的FGFR2抑制剂Pemazyre(pemigatinib)上市,治疗携带FGFR2基因融合或其它重排类型的经治晚期胆管癌成人患者。为治疗晚期胆管癌成人患者带来首款靶向疗法。
Futibatinib是一款口服、选择性、不可逆FGFR1-4小分子抑制剂。它通过与FGFR1-4的ATP结合“口袋”不可逆地共价结合,抑制FGFR介导的信号传导,从而降低携带FGFR1-4基因变异的肿瘤细胞的增殖。它已经在2018年获得FDA授予的孤儿药资格,用于治疗胆管癌。
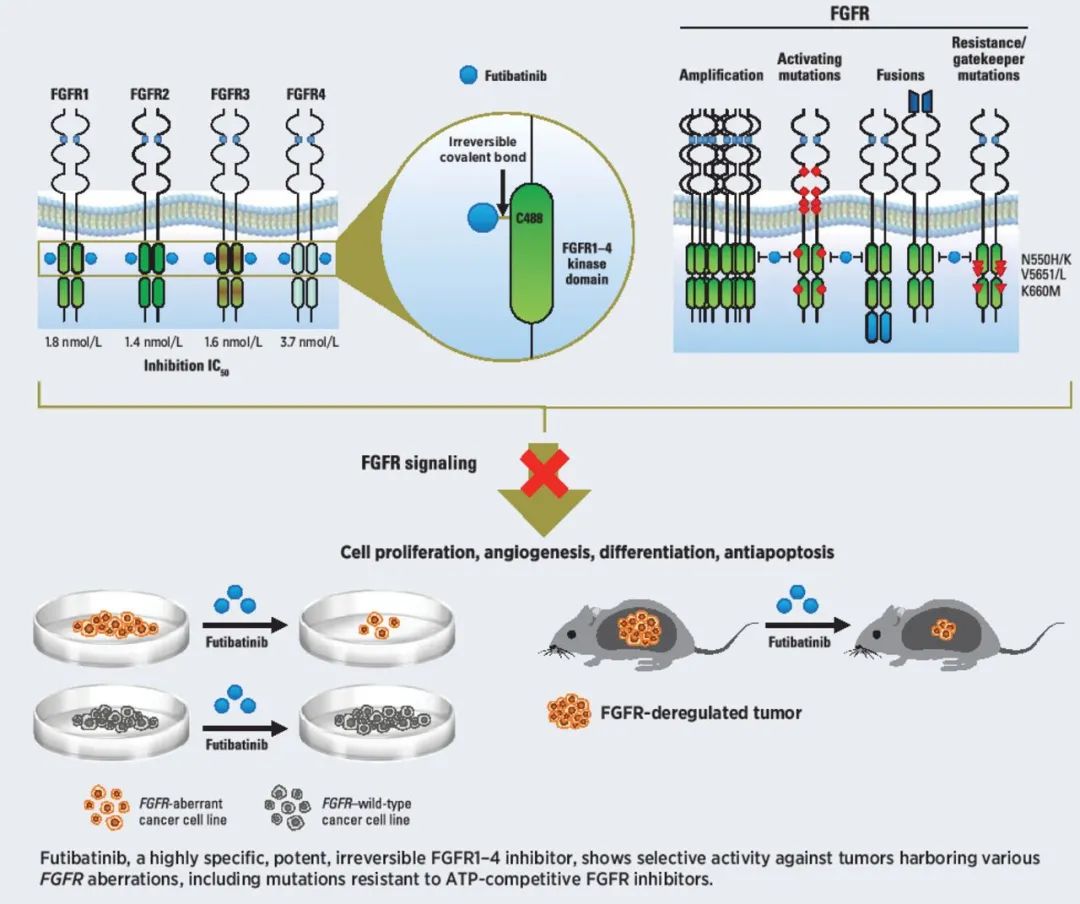
▲Futibatinib的作用机制示意图(图片来源:参考资料[3])
这一突破性疗法认定的授予是基于名为FOENIX-CCA2的2期临床试验的结果。在去年欧洲肿瘤内科学会亚洲大会(ESMO Asia)上公布的中期数据分析显示,在67名随访时间超过6个月,携带FGFR2基因融合或重排的肝内胆管癌患者中,futibatinib达到37.3%的客观缓解率(ORR),82.1%的疾病控制率,中位缓解持续时间达到8.3个月,中位无进展生存期达到7.2个月。
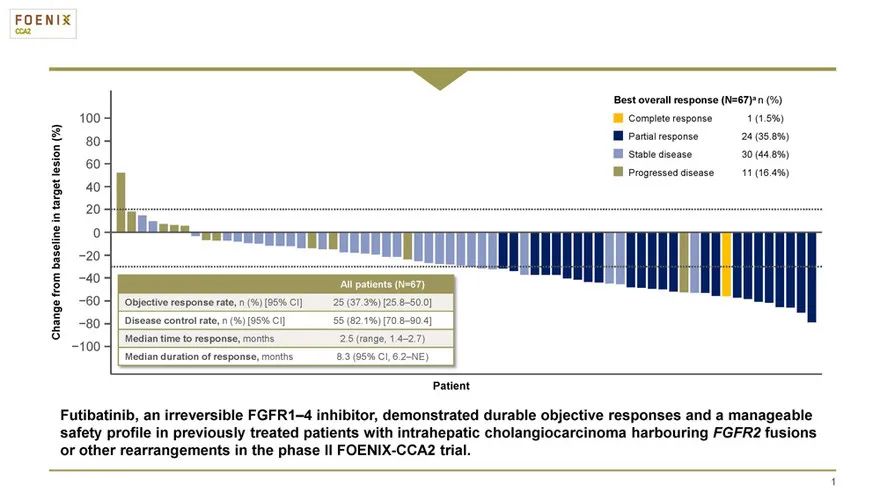
▲Futibatinib在2期临床试验中的中期分析结果(图片来源:参考资料[2])
不同亚组的患者均出现客观缓解,值得一提的是,在年龄超过65岁的患者亚群中,ORR达到57.1%。这一临床试验的最新结果将在今年4月举行的AACR年会上公布。
在中国,包括诺诚健华、信达生物、基石药业、再鼎医药在内的多家生物医药公司也在开发不同类型的FGFR抑制剂,用于治疗晚期胆管癌、肝细胞癌、胃癌等多种类型的癌症患者。详情请参阅:诺诚健华、信达生物、基石药业等都在开发,FGFR能否成为“不限癌种”疗法新星?
参考资料:
[1] FDA Grants Breakthrough Therapy Designation for Taiho Oncology's Futibatinib for Treatment of Advanced Cholangiocarcinoma. Retrieved April 1, 2021, from https://www.prnewswire.com/news-releases/fda-grants-breakthrough-therapy-designation-for-taiho-oncologys-futibatinib-for-treatment-of-advanced-cholangiocarcinoma-301260615.html
[2] FUTABATINIB FOR PATIENTS WITH INTRAHEPATIC CHOLANGIOCARCINOMA AND FGFR2 FUSIONS OR REARRANGEMENTS. Retrieved April 1, 2021, from https://www.esmo.org/oncology-news/futabatinib-for-patients-with-intrahepatic-cholangiocarcinoma-and-fgfr2-fusions-or-rearrangements
[3] Sootome et al., (2020). Futibatinib Is a Novel Irreversible FGFR 1–4 Inhibitor That Shows Selective Antitumor Activity against FGFR-Deregulated Tumors. Cancer Research, DOI: 10.1158/0008-5472.CAN-19-2568
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..