▎药明康德内容团队编辑
拜耳宣布美国FDA授予其研究性新药治疗糖尿病肾病优先审评资格
近日,拜耳(Bayer)宣布美国FDA已受理其新药申请(NDA),并授予该研究药物finerenone用于治疗慢性肾病(CKD)和2型糖尿病(T2D)患者的优先审评资格。此前,finerenone已获得美国FDA授予的快速通道资格。
本次优先审评基于名为FIDELIO-DKD的3期临床试验数据,试验结果发表在《新英格兰医学杂志》上。研究表明,对于合并慢性肾脏病的2型糖尿病患者,finerenone具有明显的肾脏和心血管益处,与现行标准治疗相比,在中位2.6年的时间中,finerenone将肾病进展减缓了18%。
Finerenone(BAY94-8862)是一种潜在的“ first-in-class“非甾体选择性盐皮质激素受体拮抗剂(MRA),可以减少盐皮质激素受体过度激活的有害作用。在FIDELIO-DKD研究中显示了finerenone在慢性肾病和2型糖尿病患者的积极肾脏和心血管结局。
慢性肾病是糖尿病最常见的并发症之一,也是心血管疾病的独立危险因素。随着病情进展,超过1/4糖尿病患者最终会出现慢性肾病,甚至发展为肾衰竭。2型糖尿病患者的慢性肾病是终末期肾病和肾衰竭的主要原因,晚期患者可能需要接受透析或肾移植才能存活。已知盐皮质激素受体过度激活可触发患者肾脏和心脏的有害过程(例如炎症和纤维化)。
赛诺菲11亿美元预付款收购Kymab,囊获一款靶向OX40L单抗
赛诺菲(Sanofi)近日宣布收购Kymab,将KY1005加入其管线,这是一种靶向关键免疫系统调控因子OX40L的全人源单克隆抗体。根据该协议,赛诺菲将以约11亿美元的预付款收购Kymab。赛诺菲预计将在2021年上半年完成收购。
此次交易将使赛诺菲获得KY1005的全部全球权利,KY1005是一种具有新型作用机制的全人源单克隆抗体。KY1005与OX40L结合,有可能治疗多种免疫介导的疾病和炎症性疾病。在2020年8月,Kymab曾宣布,KY1005在外用皮质类固醇不能充分控制病情的中重度特应性皮炎(俗称湿疹)患者的一项2a期临床试验中达到了两个主要终点,主要终点设定为湿疹面积和严重程度指数(EASI)以及其他客观临床指标。
Kymab是一家开发全人源单克隆抗体用于免疫介导疾病和免疫肿瘤学的临床阶段生物制药公司,Kymab利用其专有的技术平台(统称为IntelliSelect)开发全人源单克隆抗体治疗药物。Kymab的IntelliSelect平台包含了各种人类抗体,这使其成为可用的最全面的抗体平台。Kymab的研发管线还包括肿瘤资产KY1044,这是一种靶向ICOS的单克隆抗体,目前正处于1/2期临床试验开发阶段,可单药或与一种抗PD-L1药物联合使用。此次收购也为赛诺菲提供了获得抗体新技术和研究能力的途径。
治疗阿尔茨海默病,神经刺激创新疗法获FDA突破性医疗器械认定
Cognito Therapeutics公司近日宣布,其主打产品获得了美国FDA的突破性医疗器械认定(Breakthrough Device Designation),用于治疗与阿尔茨海默病相关的认知和功能症状。该产品是一种促进大脑Gamma神经振荡(Gamma oscillation)的非侵入性神经刺激器械,是该公司治疗神经退行性疾病和其他慢性适应症的数字治疗管线中的首个产品。
FDA突破性医疗器械项目旨在帮助患者更及时地获得创新技术,可以为危及生命或不可逆衰弱性疾病提供更有效的治疗或诊断。FDA将与Cognito进行关于器械开发和临床试验方案方面的互动沟通,并将对潜在监管申请提供优先审评。
阿尔茨海默病是老年人中最常见的神经退行性疾病,不但对患者本身,而且对他们的家庭、社区和整个社会都有相当严重和深远的负面影响。而且自2003年以来,FDA尚未批准任何治疗阿尔茨海默病的创新疗法。这一领域存在尚未满足的重大医疗需求。

Cognito Therapeutics公司开发的数字疗法是基于其联合科学创始人,麻省理工学院的Edward S. Boyden和Li-Huei Tsai博士的突破性研究。在2016年发表在《自然》上的动物研究表明,阿尔茨海默病小鼠模型的动物大脑中Gamma神经振荡出现异常。Gamma神经振荡是频率范围在30~100 Hz内的一种脑内神经元同步化活动,抑制性中间神经元组成的神经网络是产生此高频节律性活动的主要发生器。
而更为重要的是,研究人员发现通过特定声光刺激调整动物的Gamma神经振荡可以起到促进大脑中的小胶质细胞转变为吞噬形态,帮助消除大脑中的淀粉样蛋白沉积的作用。
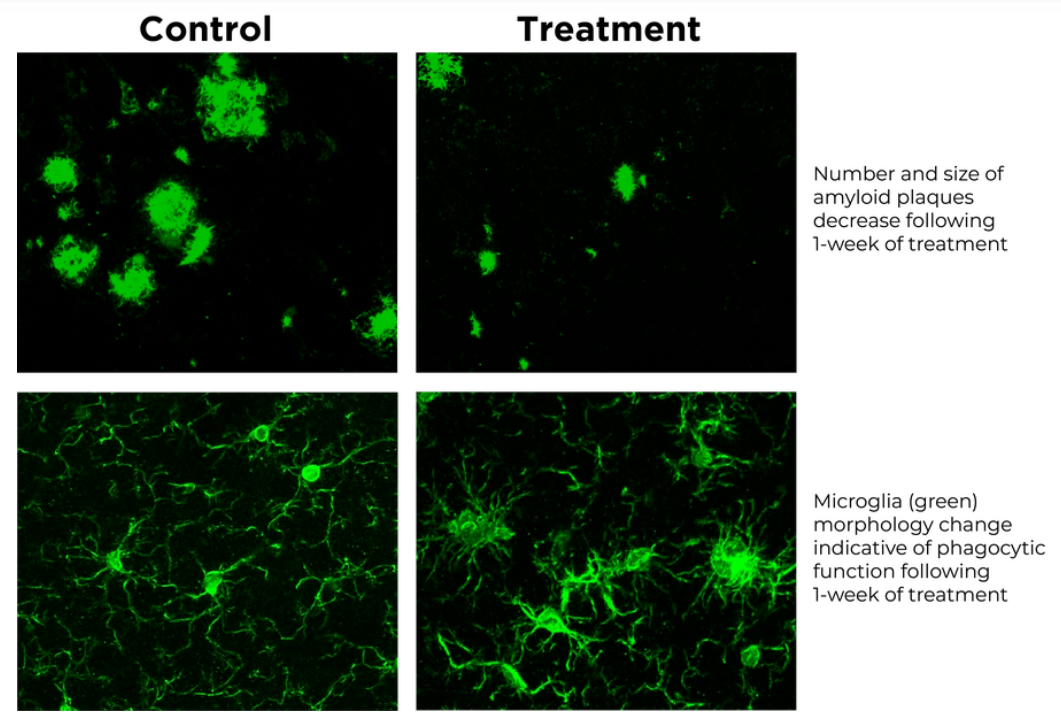
▲一周治疗可以减少淀粉样蛋白斑块的数目和大小(上面的两张图),并且改变小胶质细胞的形态(图片来源:Cognito公司官网)
一次治疗降低坏胆固醇61%,基因编辑疗法动物实验显示持久疗效
Verve Therapeutics近日宣布,其基因编辑疗法VERVE-101,在非人灵长类动物实验中,一次治疗可以在随后至少6个月让血液低密度脂蛋白胆固醇(LDL-C)水平得到持久和一致的降低。该公司选择VERVE-101作为其先导产品推入临床开发阶段,最初用于治疗杂合体家族性高胆固醇血症(HeFH)。VERVE-101是一种靶向PCSK9基因的单碱基编辑疗法,使用工程化脂质纳米颗粒递送,旨在通过一次治疗,永久性降低患者的心血管疾病风险。
HeFH在全球范围内大约每200至500人中就有1人受累。患者通常携带LDL受体(LDLR)基因突变,导致LDLR表达下降,引起血液中LDL-C水平升高。随着时间的推移,高LDL-C在心脏动脉中蓄积,导致血流减少或阻塞,最终导致心脏病发作或卒中。此前研究已证明PCSK9基因失活可上调LDL受体表达,从而导致LDL-C水平降低,降低冠心病风险。VERVE-101通过使PCSK9的DNA遗传序列发生单一的A到G的改变,导致PCSK9基因失活。
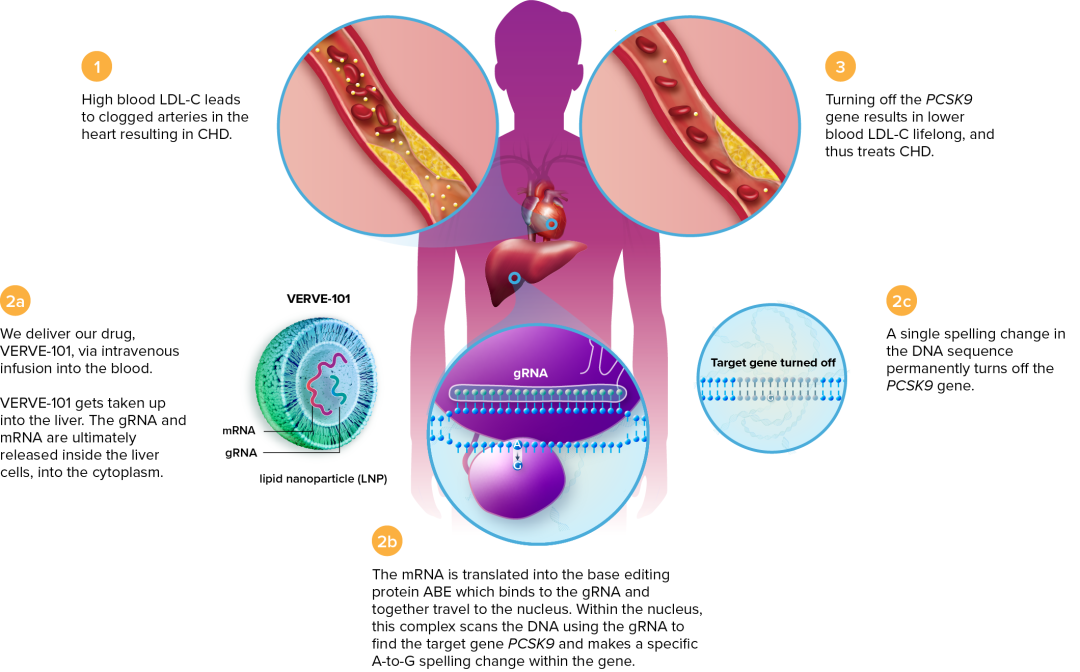
▲VERVE-101的作用机理(图片来源:Verve Therapeutics公司官网)
最新数据证明,在非人灵长类动物肝脏中对PCSK9基因进行体内单碱基编辑可持久、一致地降低血液LDL-C和血液中PCSK9蛋白水平。在研究中,单次静脉输注在第2周实现了血液LDL-C降低59%,并在治疗后6个月内得到维持。该时间段内LDL-C平均降低61%。在相同的6个月时间段内,平均血液PCSK9蛋白水平降低了89%。
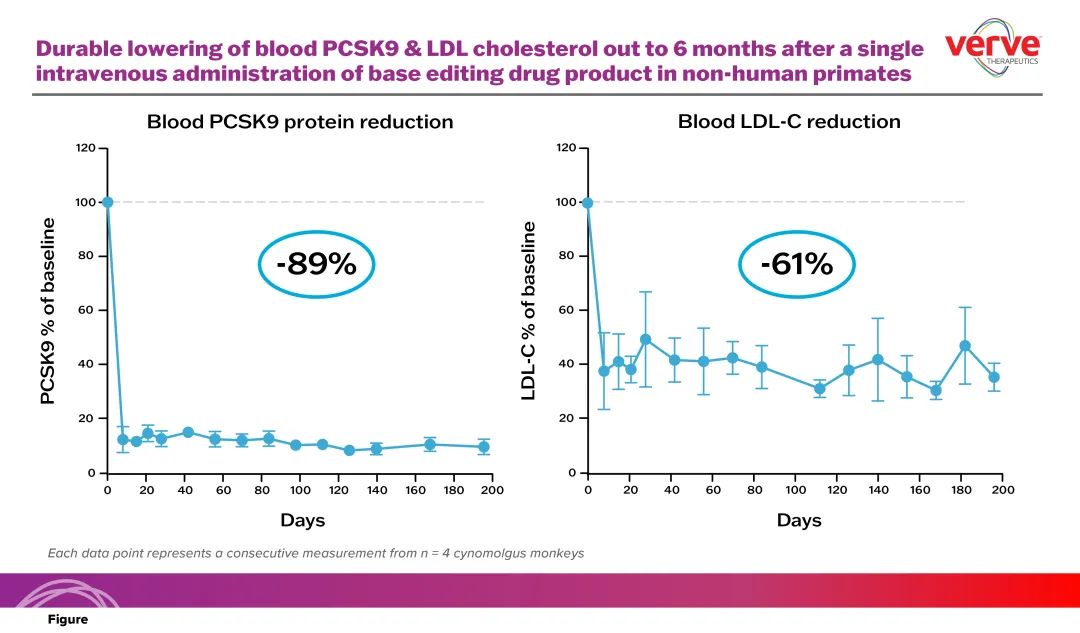
▲VERVE-101持续降低血液中PCSK9蛋白和LDL-C蛋白水平(图片来源:参考资料[5])
诺华新一代IgE抗体疗法获FDA突破性疗法认定
诺华(Novartis)公司近日宣布,美国FDA已授予其新一代IgE抗体疗法ligelizumab(QGE031)突破性疗法认定,用于治疗抗组胺疗法应答不足的慢性自发性荨麻疹(CSU)患者。
CSU是一种难于预测的重度皮肤疾病,影响0.5-1%的全球人群。其特征为出现瘙痒、疼痛性荨麻疹、或/和肿胀,持续至少6周,且发生原因未知。由于CSU的严重程度和不可预测的性质,对患者的生活质量造成严重影响。
Ligelizumab(QGE031)是新一代单克隆抗免疫球蛋白E(IgE)抗体。Ligelizumab被认为通过阻断IgE/FcεRI通路起作用,该通路是CSU中炎症过程的关键驱动因子。
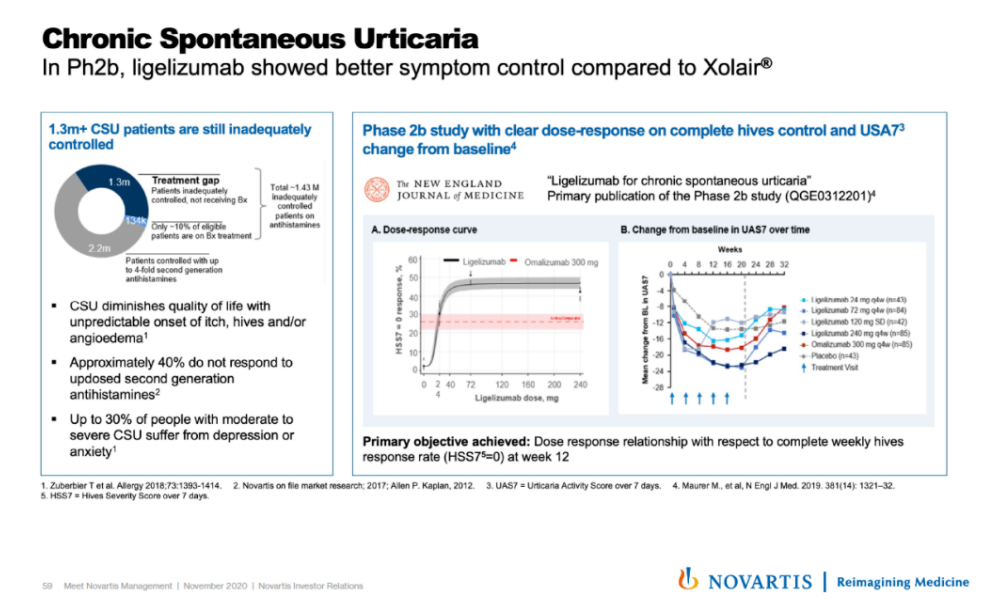
▲Ligelizumab的一项2b期临床试验结果(图片来源:诺华官网)
在一项2b期剂量探索试验中,与上一代IgE抗体omalizumab相比,更多的患者使用ligelizumab后症状完全消退。在一项针对抗组胺药控制不佳的CSU患者的2b期剂量探索试验中,与omalizumab或安慰剂相比,未发现ligelizumab的安全性问题。目前正在进行的3期临床试验项目已在全球48个国家招募了超过2000例患者,预期在2021年下半年获得结果。
除了ligelizumab以外,诺华还在2期临床试验中检验布鲁顿氏酪氨酸激酶(BTK)抑制剂remibrutinib(LOU064)治疗慢性自发性荨麻疹的效果。
默沙东15价肺炎链球菌疫苗获FDA优先审评资格
默沙东(MSD)公司宣布,美国FDA已经接受该公司为在研15价肺炎链球菌疫苗V114递交的生物制品许可申请(BLA),用于在18岁以上成人中预防侵袭性肺炎球菌疾病。FDA同时授予这一申请优先审评资格,预计在今年7月18日之前做出回复。欧洲药品管理局(EMA)也在审评V114的监管申请。
肺炎球菌疾病是一种由肺炎链球菌引起的感染。高度侵袭性菌株或血清型可能使更多人面临罹患非侵袭性肺炎球菌疾病(例如肺炎球菌性肺炎、鼻窦炎和中耳炎)和侵袭性肺炎球菌性疾病(例如肺炎球菌菌血症、菌血症性肺炎和肺炎球菌性脑膜炎)。虽然健康成人和儿童可能患上肺炎球菌疾病,但易感人群包括2岁以下的儿童、65岁以上的老年人,以及患有免疫抑制或某些慢性疾病的人群。
V114是默沙东开发的用于预防成人和儿童肺炎球菌疾病的15价肺炎链球菌结合疫苗。它由与CRM197载体蛋白结合的15种血清型的肺炎链球菌多糖组成,包括血清型22F和33F。这些血清型通常与全球侵袭性肺炎球菌疾病相关,并且不包含在目前批准用于成人的肺炎链球菌结合疫苗中。
这一BLA申请和优先审评资格的授予得到了一系列2期和3期临床研究的支持,这些研究检验了这款疫苗在多种不同成人群体中的效果和安全性,包括健康成年人和风险增加的成年人,如患有慢性疾病的成年人、HIV感染者以及65岁以上的老年人。BLA中的其他研究支持V114在各种真实临床环境中的潜在使用,包括与四价流感疫苗联合使用和作为PNEUMOVAX23序贯给药的一部分,并证明了不同批次的V114具有相同的效力。
注:本文旨在介绍医药健康研究,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
参考资料:
[1] Bayer Announces U.S. FDA Accepts New Drug Application and Grants Priority Review for Investigational Drug Finerenone for Patients with Chronic Kidney Disease and Type 2 Diabetes. Retrieved 2021-01-12, from https://www.businesswire.com/news/home/20210112005050/en/Bayer-Announces-U.S.-FDA-Accepts-New-Drug-Application-and-Grants-Priority-Review-for-Investigational-Drug-Finerenone-for-Patients-with-Chronic-Kidney-Disease-and-Type-2-Diabetes.
[2] Sanofi to acquire Kymab, adding KY1005 to its pipeline, a human monoclonal antibody targeting key immune system regulator OX40L. Retrieved 2021-01-11, from https://www.globenewswire.com/news-release/2021/01/11/2155914/0/en/Sanofi-to-acquire-Kymab-adding-KY1005-to-its-pipeline-a-human-monoclonal-antibody-targeting-key-immune-system-regulator-OX40L.html.
[3] Cognito Therapeutics Receives FDA Breakthrough Device Designation for Next-Generation Digital Therapeutic in Alzheimer’s Disease. Retrieved January 12, 2021, from https://www.businesswire.com/news/home/20210112005364/en
[4] Iaccarino et al., (2016). Gamma frequency entrainment attenuates amyloid load and modifies microglia. Nature, doi:10.1038/nature20587.
[5] Verve Therapeutics Announces Data Demonstrating Durable LDL Cholesterol Lowering After a One-Time Gene Editing Treatment in Non-Human Primates. Retrieved January 12, 2021, from https://www.businesswire.com/news/home/20210112005258/en
[6] Verve Therapeutics. Retrieved January 12, 2021, from https://www.vervetx.com/
[7] Novartis ligelizumab (QGE031) receives FDA Breakthrough Therapy designation for patients with chronic spontaneous urticaria (CSU). Retrieved January 14, 2021, from https://www.novartis.com/news/media-releases/novartis-ligelizumab-qge031-receives-fda-breakthrough-therapy-designation-patients-chronic-spontaneous-urticaria-csu
[8] U.S. FDA Accepts for Priority Review the Biologics License Application for V114, Merck’s Investigational 15-valent Pneumococcal Conjugate Vaccine, for Use in Adults 18 Years of Age and Older. Retrieved 2021-01-12, from https://www.businesswire.com/news/home/20210112005398/en
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..