2021年1月12日,国家癌症中心/中国医学科学院肿瘤医院/药物临床试验研究中心(GCP)李宁教授团队 在 Cancer Cell 杂志发表了题为:The Landscape of Cell and Gene Therapies for Solid Tumors 的最新综述论文。对世界范围内细胞和基因治疗的现状,尤其是针对实体瘤的临床应用进行了综合分析。
李宁教授为该论文的通讯作者,国家癌症中心/中国医学科学院肿瘤医院/药物临床试验研究中心(GCP)王书航医生、黄慧瑶博士以及贵州省人民医院孙发教授为该论文的共同第一作者,贵州省人民医院陈琨博士亦为研究的主要作者之一。
细胞治疗和基因治疗具有多种作用机制和多样的活性成分,作为治疗恶性肿瘤的新策略,在世界范围内的临床试验中被广泛研究,其中部分产品已获批准,绝大部分都还在早期研究中。因此,在这一领域,争议、机遇与挑战并存。
细胞治疗通常指过继细胞疗法(ACT),主要通过免疫细胞来杀伤肿瘤。细胞治疗可按照机制分类为非基因编辑和基因编辑的细胞产品,或根据细胞类型分类为T细胞、NK细胞(自然杀伤细胞)、DC(树突状细胞)、CIK细胞(细胞因子诱导杀伤细胞)、TILs(肿瘤浸润淋巴细胞)和MSC(间充质基质细胞)。非基因编辑和基因编辑的细胞治疗均在进行广泛的临床研究,同时部分已经获得临床适应症,包括T细胞(CAR-T、TCR-T和gd T细胞以及基因编辑的T细胞)、TILs、DCs和巨噬细胞等。
基因治疗旨在修饰或操纵基因的表达或改变活细胞的生物学特性以用于治疗用途。根据治疗方法,基因疗法可分为体内或体外,根据基因导入系统可分为病毒载体和非病毒载体。基因编辑的细胞治疗属于体外基因治疗范畴,将细胞(正常细胞或肿瘤细胞)从患者体内取出,并将靶基因(DNA或RNA)导入体外培养的细胞中,再选择高表达靶基因的细胞进行扩增,最后将其移植回患者达到治疗肿瘤的目的。体内基因治疗是指通过载体将靶基因直接引入患者的细胞,如溶瘤病毒(oncolytic virus,OVs)具有良好的肿瘤溶解效应、肿瘤选择性和较高的免疫原性,是一种很有前景的体内基因治疗方法。
细胞和基因疗法在治疗实体肿瘤方面已显示出巨大的潜力。从2010年1月1日到2019年12月31日,在全球范围内对178种细胞和基因疗法进行了491项临床试验(INFORMA数据库)。相关临床试验的数量平均每年增长16.1%,2017年几乎比前一年翻了一番。细胞和基因治疗中I期和II期临床试验占每年新开试验的90%以上(图A)。

图A:2010-2019年细胞和基因治疗临床试验的全球分布
这些试验涵盖了26种实体瘤类型,其中黑色素瘤、非小细胞肺癌(NSCLC)和卵巢癌是最常见的三种(图B)。

图B:细胞和基因治疗在不同实体瘤亚型中临床试验的全球分布
在过去十年中,世界范围内总共进行了318项细胞治疗的临床试验,涵盖了从早期实体瘤新辅助治疗到晚期实体瘤末线的所有治疗阶段(图C),其中晚期实体瘤占绝大部分(88.1%,图D)。疫苗在实体瘤所有治疗阶段的研究均较多。此外,INFORMA还注册了374项基因治疗(包括基因编辑细胞治疗)的临床试验。
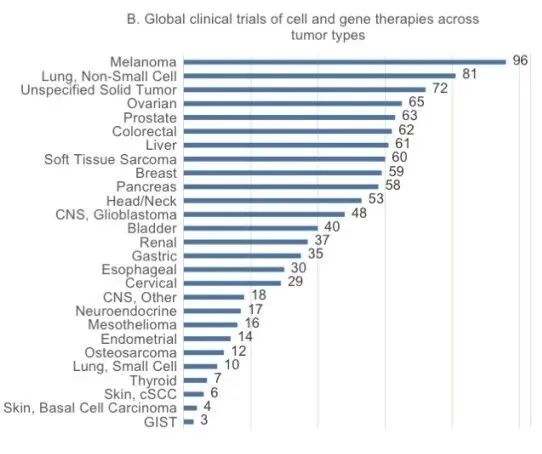
图C:细胞和基因治疗临床试验中受试者治疗阶段的分布
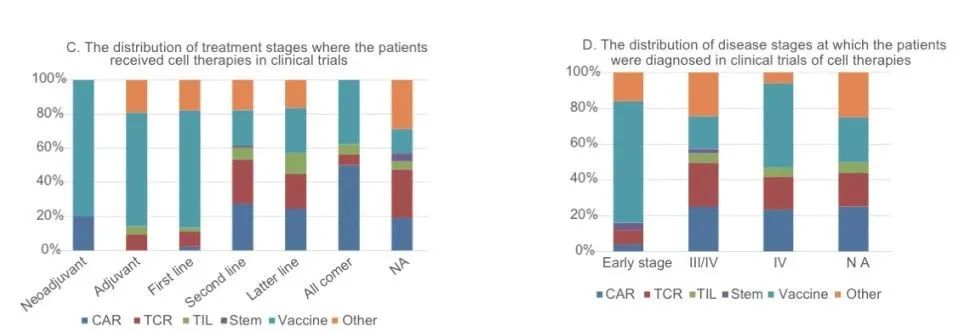
图D:细胞治疗临床试验中入组受试者肿瘤分期的分布
尽管中国在细胞和基因治疗临床试验数量上排名第二,但中国与排名第一的美国之间仍有很大差距,比如整体数量上中国39项,美国120项(图E)。
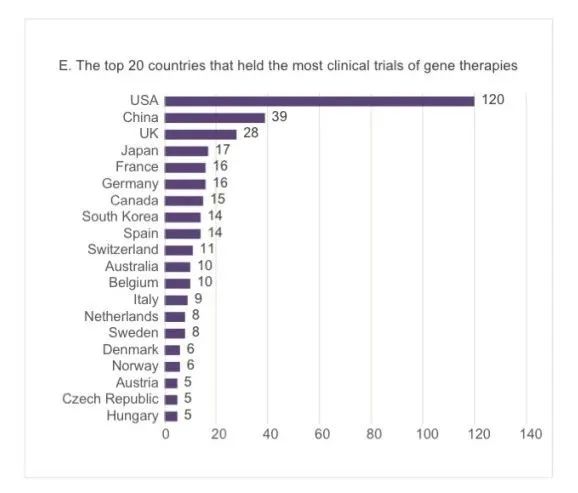
图E:基因治疗临床试验数量排名前20的国家
中国的CAR-T和TCR-T试验分别为14个和5个,而世界其它地区(不包含中国)分别为22个和16个。中国和世界其它地区在这些试验中的靶点情况也有所不同。中国和中国以外其他国家前3位CAR-T靶点分别为glypican-3、IL13Rα2/CEA/MUC1和claudin 18.2/AFP,以及间皮素、NKG2D和IL13Rα2/CEA/MUC1;TCR-T前3位靶点分别是中国的NY-ESO-1、HBV和hpve6,以及其他国家的NY-ESO-1、个体化肿瘤特异性新抗原和MAGE-A4,HBV和HPV E6在中国的高表达反映了中国人群HBV相关肝癌和HPV相关宫颈癌的高发的区域性特点。
另外,在中国细胞治疗的临床实现集中在少数大城市,比如上海、广州和北京,其次是深圳、杭州和南京。
基于研发、实施及相关政策上的不完整性,大多数细胞和基因治疗在实体瘤方向的研究都停留在I或II期临床试验。
主要的挑战如下:首先,在实体瘤细胞表面明确的肿瘤特异性抗原少。第二,实体瘤的抗原具有较大的异质性。第三,基因转导的T细胞在是实体瘤瘤体中的浸润有限。第四,免疫抑制的肿瘤微环境是晚期肿瘤患者的共同特征,T细胞衰竭较为普遍。最后,生物标志物筛选的临床试验有限,仅占细胞治疗试验的19.2%(61/318)和基因治疗试验的14.7%(55/374),不能早期和快速富集治疗可能有效的人群。
此外,还存在操作流程上的挑战,比如,如何简化细胞和基因治疗的制备工艺,优化保存、运输和输注?如何为参与细胞和基因治疗试验的各方提供更高效的相关培训?
在细胞和基因治疗不断的发展过程中,目前已经有了一些解决问题的策略,例如,优化CAR的设计,提高细胞的肿瘤浸润能力以及改善肿瘤免疫抑制的微环境等。此外,不同机制治疗方法与细胞基因治疗的联合应用也有希望进一步提高疗效。同时,新的制造工艺的开发也促进了细胞基因治疗的发展,比如第2代TILs产品的生产工艺,只需22天即可完成细胞制备,原来则需要6周。用于治疗黑色素瘤和宫颈癌的第2代TILs产品在美国已加速商业化进程。
综上所述,细胞和基因治疗已被广泛研发用于治疗实体瘤,覆盖几乎所有实体瘤种类的临床试验均在迅速增加,尤其在2017年之后。细胞和基因治疗在实体瘤中的治疗仍然面临许多挑战,需要科学家不断提出新的解决方案才能进一步促进细胞和基因治疗有效而广泛的临床应用。
论文链接
https://doi.org/10.1016/j.ccell.2020.12.005
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..