12月3日,强生旗下杨森公司宣布已经向FDA提交了amivantamab(EGFR/c-Met双抗)的上市申请,用于治疗铂类化疗后进展的EGFR外显子20插入突变的转移性非小细胞肺癌(NSCLC)患者。针对该适应症,amivantamab在今年3月获得了FDA授予的突破性疗法资格。
EGFR突变是非小细胞肺癌患者常见的基因突变,大约占到10%~15%,在亚洲人群中,这一数值大约为40%~50%。EGFR外显子20插入突变大约占到所有EGFR突变非小细胞肺癌患者的9%。EGFR外显子20插入突变的非小细胞肺癌患者通常对EGFR-TKI治疗不敏感,与更常见的EGFR突变(外显子19缺失/L858R替代)患者相比,预后更差。目前,该类患者的标准疗法为常规的细胞毒药物化疗。
FDA尚未批准专门治疗EGFR外显子20插入突变NSCLC患者的靶向疗法,amivantamab是首个向监管机构提出上市申请用于治疗这类患者的药物。为此,强生同时推出了“扩大获取计划(EAP)”。在amivantamab接受FDA审批期间,美国符合条件的患者即有可能接受该药治疗。
Amivantamab是一种靶向作用于EGFR耐药突变、MET突变和扩增的双特异性抗体,可以同时结合EGFR和c-Met的胞外结构,阻断配体与EGFR和MET的结合,促进受体降解,还可触发抗体依赖性细胞毒性。
强生此次提交上市申请是凭借I期CHRYSALIS研究中amivantamab单药疗法队列的数据。CHRYSALIS研究是多中心、开放标签、多队列试验,评估了amivantamab单药以及联合lazertinib(EGFR T790M抑制剂)治疗成人晚期NSCLC的疗效和安全性数据。其中amivantamab单药治疗EGFR外显子20插入突变NSCLC患者队列的早期数据已经在ASCO2020大会上公布。
数据显示,全部39例可评估患者的ORR为36%,中位缓解持续时间(DOR)为10个月,中位PFS为8.3个月;既往接受过含铂化疗患者的ORR为41%(12/29),中位DOR为7个月,中位PFS为8.6个月。
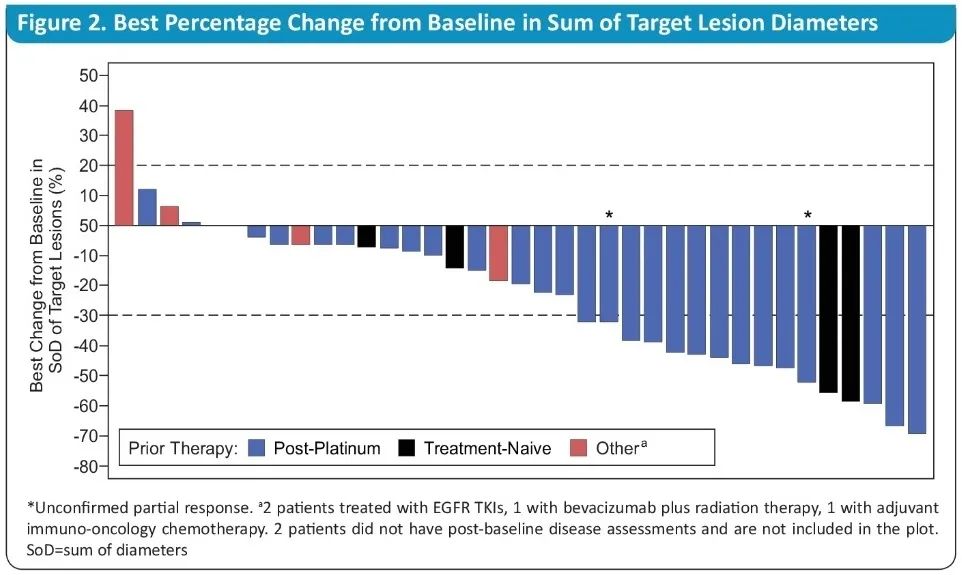

来源:ASCO2020
在ESMO2020大会上,强生公布了amivantamab联合口服 lazertinib 的疗效数据。在20 例初次接受治疗的患者组中,中位随访时间为7 个月时,客观缓解率达到 100%。在 45 例奥希替尼耐药、未接受过化疗患者中,联合疗法的客观缓解率达到 36%,其中包括 1 例患者完全缓解,15 例患者部分缓解。
9月23日,Amivantamab在中国有2项临床试验申请获得默示许可,分别为:1)联合治疗EGFR 19号外显子缺失或L858R激活突变,未经过既往治疗的局部晚期或进展性NSCLC患者;2)联合用药治疗EGFR 19号外显子缺失或L858R激活突变,且在使用第一代(例如厄洛替尼、吉非替尼等)或第二代(例如阿法替尼、达克替尼等)TKI进行一线治疗或在使用第三代TKI(例如,奥希替尼)进行一线或二线治疗后出现疾病进展的NSCLC患者。
10月17日,amivantamab在中国也被CDE授予了突破性疗法资格,用于治疗含铂双药化疗期间或之后进展,或对含铂化疗不耐受的携带表皮生长因子受体(EGFR)20号外显子插入突变的转移性或手术不可切除的非小细胞肺癌患者。
全球在研EGFR/c-Met双抗
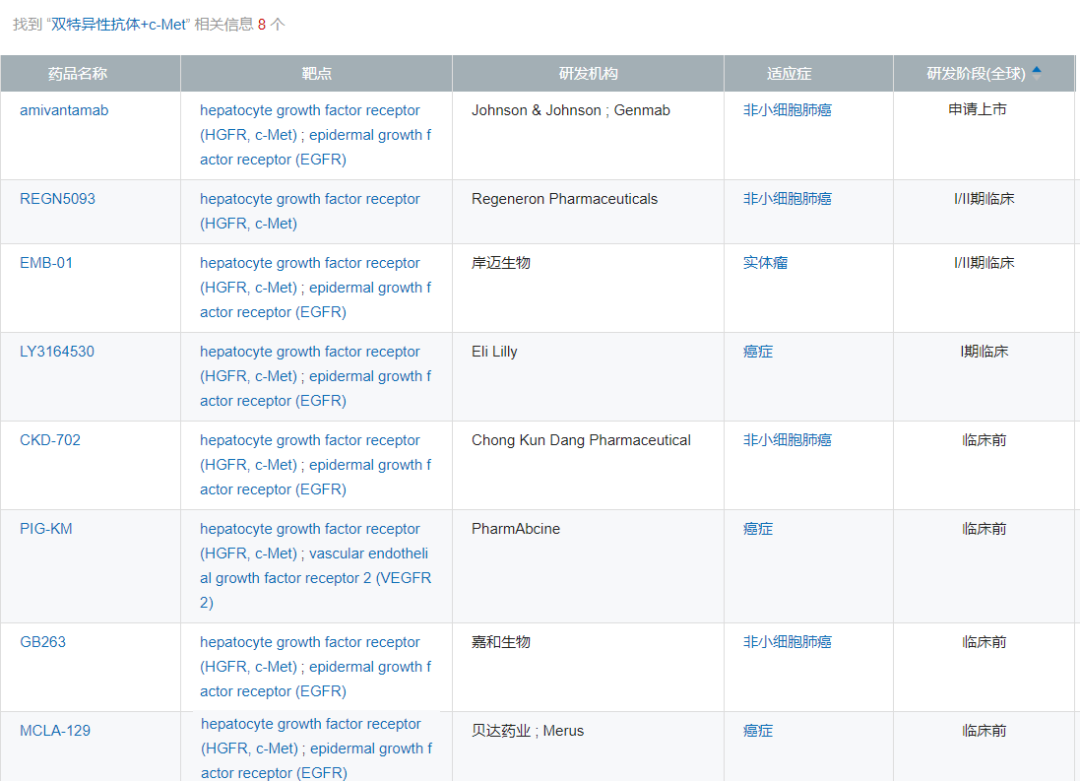
来源:NextPharma
目前,全球共有8款EGFR/c-Met双抗。国内企业中进展最快的是岸迈生物的EMB-01,今年6月份在AACR会议上曾刚公布过EMB-01的临床前数据。
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..