自2015年8月18日,国务院发布《关于改革药品医疗器械审评审批制度的意见》,开启药品审评审批制度改革至今已整整五年时间。
5年来,国家药监部门以前所未有的速度和力度推动各项改革,药审改革也取得非常不错的成绩,药品审评审批提速,创新药加快上市,仿制药一致性评价稳步推进,真实世界数据探索不断推进……
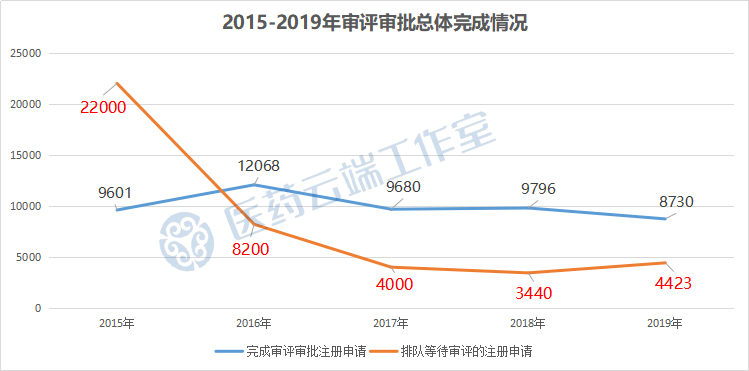
药审提速,从近22000件降至4423件,工作重点已经由解决药品注册申请积压逐渐过渡为提升药品注册申请的按时限审评审批率
在业内看来,启动药审改革的初衷是为了解决注册审批慢、申请积压多等问题。2015年发布的《意见》中也明确提出“解决注册申请积压,争取2016年底前消化完注册申请积压存量,2018年实现按规定时限审批”。
根据最近发布的《2019年度药品审评报告》显示,2015年至2018年期间药审中心通过扩充审评通道、强化审评项目管理、大规模招聘人员、借调省局人员等措施多渠道扩增审评力量、提高审评效率,使得药品注册申请积压基本得以解决。
药审中心的工作重点已经由解决药品注册申请积压逐渐过渡为提升药品注册申请的按时限审评审批率,2019年药审中心实现了中药、化学药、生物制品各类注册申请按时限审评审批率超过90%。
根据药审中心每年发布的药品审评报告中我们也不难看出从审评数量、质量和时限看,审评审批制度改革成效显著。
2016年,药审中心完成审评注册申请12068件;全年完成审评的注册申请数量较2015年提高了26%,排队等待审评的注册申请已由2015年9月高峰时的近22000件降至8200件。
2017年全年完成审评审批注册申请9680件;排队等待审评的注册申请降至4000件。
2018年全年完成审评审批注册申请9796件;排队等待审评审批的注册申请降至3440件。
2019年全年完成审评审批注册申请8730件。截至2019年底,排队等待审评的注册申请已降至4423件。
建立优先审评审批制度,大大缩短注册时间
药审改革始于解决申请积压,但并非止步于审批加速。
“鼓励创新”是药审改革的灵魂。《意见》提出“全球新”概念,并提出对临床急需、市场短缺的药品实施优先审评审批、优化各环节资源配置等要求。
近3年来,为了解决药品注册申请积压并使临床急需药品及时上市,在不断招兵买马扩大审评队伍的同时,原 CFDA分别于2016年2月26日发布《关于解决药品注册申请积压实行优先审评审批的意见》,2017年12月28日发布《关于鼓励药品创新实行优先审评审批的意见》。
2018年7月,国家药监局发布《关于调整药物临床试验审评审批程序的公告》,将“点头”许可制度改为“摇头”默许审批制度。
药品注册审评体系作为改善药品可获得性的重要政策,优先审评审批制度的实施对企业研发方向具有指导性的意义,让创新及临床急需药品缩短注册时间,这从根本上确立了医药研发导向,确定了我国医药行业的发展方向,最终缓解药品市场的供需矛盾,惠及大众。
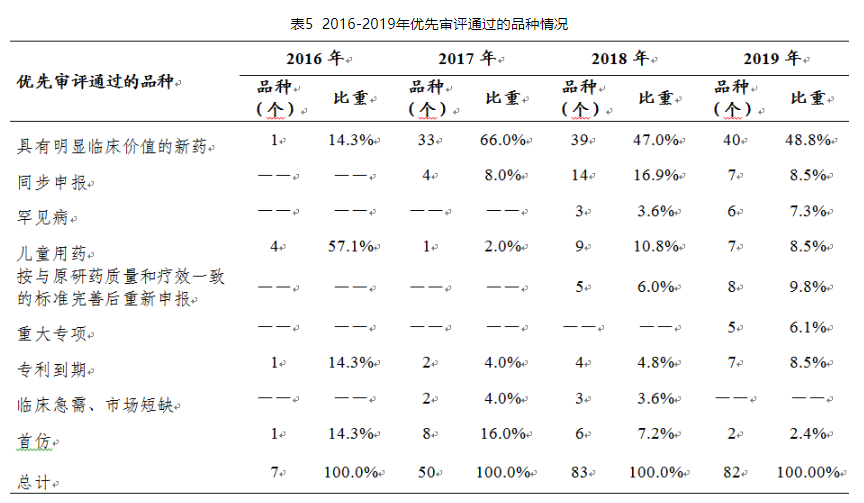
根据各年药品审评报告中显示,截至2017年共有110件注册申请通过优先审评程序得以加快批准上市(以通用名计算,共涉及57个品种),2018年,共有83个品种通过优先审评程序得以加快批准上市(以通用名计算),2019年有143件注册申请(按通用名计82个品种)通过优先审评程序,得以加快批准上市。
创新药注册申请和获批数量持续增长
与此同时,加快引进境外上市新药也成为工作重点。
2018年5月,国家药监局、国家卫生健康委联合发布《关于优化药品注册审评审批有关事宜的公告》,大幅简化境外上市新药审批程序。同年10月,两部门联合发布《临床急需境外新药审评审批工作程序》,明确建立专门通道进行临床急需境外新药审评。随后两批临床急需境外新药目录先后公布。
2019年8月新修订《药品管理法》颁布,将行之有效的药审改革措施固化为法律成果。2020年3月,新修订《药品注册管理办法》出台。新修订《药品注册管理办法》增设药品加快上市注册章节,设立突破性治疗药物程序、附条件批准程序、优先审评审批程序、特别审批程序四个加快通道,鼓励创新和满足临床急需。
在政策推动下,我国创新药注册申请和获批数量也在持续增长。2016年药审中心共受理化药创新药注册申请90个品种,较2015年增长18%;2017年上升为149个,较2016年增长了66%。2018年受理1类创新药注册申请264个,较2017年增长了21%;2019年上升为319个,较2018年增长了20.8%。
“突破性治疗”特殊审评通道正式启动
2020年7月1日起施行新修订的《药品注册管理办法》明确,药物临床试验期间,用于防治严重危及生命或者严重影响生存质量的疾病且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等,申请人可以在Ⅰ、Ⅱ期临床试验阶段,通常不晚于Ⅲ期临床试验开展前申请适用突破性治疗药物程序。
2020年7月8日,国家药监局发布《突破性治疗药物审评工作程序(试行)》等三个文件,以配合《药品注册管理办法》实施。本公告自发布之日起施行。
2020年8月5日,CDE“突破性治疗公示”专栏的首次公示,南京传奇生物旗下生物制品1类新药LCAR-B38M CAR-T细胞自体回输制剂(简称:LCAR-B38M细胞制剂)拟纳入突破性治疗药物名单。这也意味着“突破性治疗”这项特殊审评通道今正式启动。将进一步加快新药、新技术进入临床的速度。
真实世界研究走进国家药监政策当中
在系列举措中,还值得注意的是,真实世界研究已从个别地方试点悄然走进国家药监政策当中。
2020年1月,国家药监局发布《真实世界证据支持药物研发与审评的指导原则(试行)》,为业界利用真实世界证据支持药物研发提供指导意见。
8月3日,药审中心发布《用于产生真实世界证据的真实世界数据指导原则(征求意见稿)》,对真实世界数据给出具体要求和指导性建议,以帮助申办者更好地进行数据治理,为产生有效的真实世界证据做好准备。
令人欣慰的是,在鼓励创新的政策推动下,我国药企正逐步从“营销驱动”向“研发驱动”转型。
大力开展仿制药一致性评价
2016年3月5日,国务院办公厅印发《关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号),标志着我国仿制药质量和疗效一致性评价工作全面启动。
2017年8月,国家药品监管部门发布《关于开展仿制药质量与疗效一致性评价有关事项的公告》,明确了一致性评价受理审批、检查检验的基本流程等。同年9月8日,药审中心对外受理一致性评价申请。
为了给一致性评价顺利推进提供条件,国家药品监管部门逐步解决生物等效性试验临床试验机构资源紧张、参比制剂难获得等难题,扎实做好参比制剂遴选,豁免体内BE品种研究,强化审评、核查、检验等各项工作。
2018年12月,国家药监局发布《关于仿制药质量和疗效一致性评价有关事项的公告》,对于基药目录品种不再设置评价时限,要求基药品种自首家通过一致性评价以后,其他品种需在3年内通过评价。
2019年3月,国家药监局发布《化学仿制药参比制剂遴选与确定程序》,明确了参比制剂遴选的顺序选择。截至2020年8月5日,国家药监局已发布32批化学仿制药参比制剂目录。
2020年5月14日,国家药监局官网发布《国家药监局关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告》,明确已上市的化学药品注射剂仿制药,未按照与原研药品质量和疗效一致原则审批的品种均需开展一致性评价。
CDE官网也同步发布了《化学药品注射剂仿制药质量和疗效一致性评价技术要求》、《化学药品注射剂仿制药质量和疗效一致性评价技术要求》、《化学药品注射剂(特殊注射剂)仿制药质量和疗效一致性评价技术要求》三份技术文件正式稿。
而从CDE发布的第21批参比制剂目录开始,第一次出现注射剂,到目前为止,涉注射剂已超600个。这也预示着注射剂一致性评价工作正在不断加快脚步。
据医药云端工作室不完全统计,截止目前,共有1022个品规通过一致性评价。其中104个品种已集齐三家以上过评。
协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..