▎药明康德内容团队编辑
提高长期使用安全性!嗜睡症新疗法获FDA批准上市
Jazz Pharmaceuticals宣布,美国食品药品监督管理局(FDA)于2020年7月21日批准Xywav(钙、镁、钾和羟丁酸钠)口服液上市,用于治疗7岁及以上发作性睡病患者的猝倒症或白天过度嗜睡(EDS)。Xywav是一种羟丁酸钠产品,其独特的阳离子组成导致钠含量比目前治疗这些患者的标准疗法羟丁酸钠低92%,降低患者钠离子摄入过量的风险。
Xywav又名JZP-258,它与另一款Jazz公司治疗发作性睡病的中枢神经系统抑制剂Xyrem(羟丁酸钠)相比,钠含量减少92%,提高了患者用药的长期安全性。目前,其确切的作用机制还尚未被确认。据推测,JZP-258对发作性睡病的治疗作用基于在睡眠过程中对GABAB受体的调节。此外,JZP-258还在3期临床研究中治疗特发性睡眠过度症(idiopathic hypersomnia)。

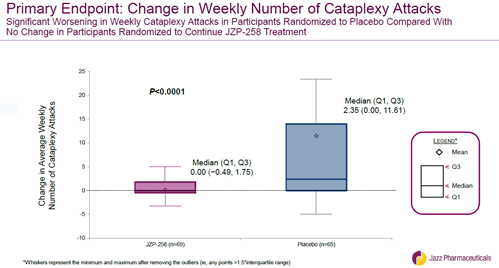
▲继续接受Xywav治疗的患者每周猝倒发作的次数显著少于安慰剂组(图片来源:Jazz Pharmaceuticals官网)
FDA批准Xywav是基于一项全球性双盲、含安慰剂对照、随机撤药的多中心3期临床研究,该研究证明了Xywav治疗发作性睡病患者猝倒和EDS的疗效和安全性。该研究共纳入201例患者,与安慰剂组相比,Xywav在每周猝倒发作次数和Epworth嗜睡量表评分方面表现出高度统计学显著差异(p<0.0001)。
抗击慢性移植物抗宿主病!JAK抑制剂喜达3期临床终点
Incyte公司宣布,该公司和诺华(Novartis)联合开发的JAK1/2抑制剂Jakafi(ruxolitinib),在治疗中度或重度类固醇难治性或类固醇依赖性慢性移植物抗宿主病(GVHD)患者的3期临床研究中达到主要终点,与最佳可用疗法(BAT)相比,第24周的总缓解率(ORR)更优。此外,该研究还达到了两个关键性次要终点,显著改善了无失败生存期(FFS)和根据mLSS症状量表评估的患者报告症状。这一研究的数据预计将在即将召开的医学大会上公布,也将准备提交给FDA,寻求在类固醇难治性或类固醇依赖性慢性GVHD患者中获得批准。
GVHD是由于异体移植的干细胞对宿主器官进行免疫攻击导致的严重疾病。GVHD分为两种形式,即急性GVHD和慢性GVHD,它可能影响皮肤、胃肠道和肝脏等多个器官系统的功能。全球每年约有3万例骨髓移植用于治疗血液系统癌症,其中儿科人群约占所有病例的20%。
Jakafi是一种创新口服Janus激酶1和2(JAK1/JAK2)抑制剂。JAKs属于细胞质酪氨酸激酶家族,其功能是转导细胞因子(如干扰素)介导的信号。JAK也是造血信号的主要组成部分,在GVHD早期有过度激活的现象。抑制JAK1/JAK2可抑制炎症性细胞因子的释放,减轻GVHD的病理进程,还可以抑制供体T细胞的激活,减轻免疫反应。Jakafi已于去年5月获得FDA批准用于治疗类固醇难治性急性GVHD。
2021年递交新药申请!创新心肌病靶向疗法斩获FDA突破性疗法认定
MyoKardia公司宣布,美国食品药品监督管理局(FDA)已授予该公司开发的mavacamten突破性疗法认定,用于治疗症状性、梗阻性肥厚型心肌病(HCM)。Mavacamten是一种新型、口服心肌肌球蛋白变构调节剂。
Mavacamten有望减少患者的心脏过度收缩症状。在临床和临床前研究中,mavacamten可以降低心壁应激的生物标志物,减轻过度的心肌收缩力和增加舒张顺应性。2016年4月,美国FDA授予mavacamten治疗HCM患者的孤儿药资格。
这一突破性疗法认定的授予是基于一项关键性3期临床研究的积极结果。试验结果显示,与安慰剂组相比,mavacamten的治疗使患者实现了运动能力变化(VO2峰值)的改善,以及纽约心脏协会功能等级(NYHA)的改善,达到了该试验的主要研究终点。此外,在所有次要终点上,mavacamten也显示了具有统计学意义的改善。次要终点包括运动后左心室流出道(LVOT)压力梯度峰值水平、NYHA、VO2峰值,以及HCM症状问卷呼吸困难评分的改善。
▲Mavacamten的疗效数据(图片来源:MyoKardia公司官网)
MyoKardia目前正在准备mavacamten的新药申请(NDA),计划在2021年第一季度提交给FDA。
靶向套细胞淋巴瘤!第三款CAR-T细胞疗法获FDA加速批准
吉利德科学(Gilead Sciences)公司旗下Kite Pharma宣布,美国食品药品监督管理局(FDA)已加速批准该公司开发的CAR-T细胞疗法Tecartus(brexucabtagene autoleucel,原名KTE-X19),用于治疗复发/难治性套细胞淋巴瘤(MCL)成人患者。新闻稿指出,这是首款获批治疗这类患者的CAR-T疗法。这也让Kite公司成为首个拥有多款获批CAR-T疗法的公司。
Tecartus是一款靶向CD19的自体CAR-T疗法。它使用了包含T细胞筛选和淋巴细胞富集的XLP制造工艺。对于某些有循环淋巴母细胞迹象的B细胞恶性肿瘤来说,淋巴细胞富集是CAR-T疗法制造的必要步骤。目前,Tecartus正在1/2期临床试验中治疗急性淋巴细胞白血病(ALL)、慢性淋巴细胞白血病(CLL)和MCL。Tecartus曾经获得FDA授予的突破性疗法认定和EMA授予的PRIME药品认定。
Tecartus的批准得到了正在进行的单组、开放标签ZUMA-2关键性临床试验数据的支持。该研究入组了74例复发/难治性MCL成人患者,这些患者既往接受过化疗、抗CD20抗体治疗和布鲁顿酪氨酸激酶抑制剂的治疗。

▲Tecartus(KTE-X19)的研发计划及进展(图片来源:Kite官网)
在这项研究中,在60名可评估疗效的患者中,87%的患者对Tecartus的单次输注产生应答,包括62%达到完全缓解(CR)的患者。在首次出现客观缓解后6个月的随访时,患者尚未达到中位缓解持续时间。
类风湿性关节炎患者福音!吉利德JAK1抑制剂获欧盟EMA委员会支持
吉利德科学(Gilead Sciences)和Galapagos公司宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已对双方联合开发的JAK1抑制剂Jyseleca(filgotinib)采取积极意见,支持其获批治疗对一种或多种疾病修饰抗风湿药物(DMARDs)反应不足或不耐受的中重度类风湿性关节炎(RA)成人患者。
Filgotinib是吉利德科学和Galapagos公司联合开发的JAK1选择性抑制剂。JAK激酶依赖性细胞因子与许多炎症性和自身免疫性疾病的发病机制相关。这一特性表明, JAK抑制剂可以用于治疗多种炎症性疾病,其中包括类风湿关节炎的治疗。目前,filgotinib的新药申请也在接受美国FDA的审评,有望在今年夏天获得批准。
CHMP的积极意见得到了3期临床研究FINCH和2期临床研究DARWIN项目数据的支持,所有三项FINCH试验均达到了其主要终点。在FINCH和DARWIN试验中,每日一次的filgotinib单药治疗或与MTX联合治疗均显示出一致的临床安全性特征。
1.35亿美元D轮融资!知名风投助力基因疗法2.0走向临床
致力于开发精准基因疗法的Encoded Therapeutics公司宣布完成数额为1.35亿美元的D轮融资。投资者包括GV(前谷歌风投)、Matrix Capital Management和ARCH Venture Partners。本轮融资获得的资金将用于推动其治疗Dravet综合征的精准基因疗法。具体包括一项将于2020年下半年进行的关于SCN1A阳性Dravet综合征的自然史研究;以及一项计划于2021年开始的1期临床研究;还将支持一系列针对其他儿科中枢神经系统(CNS)疾病的更早期阶段的基因疗法研发。
Encoded公司的领先疗法旨在治疗Dravet综合征,这一罕见遗传病源于SCN1A基因上的失能性基因突变,导致基因功能丧失50%。这导致患者出现无法控制的癫痫发作、共济失调和发育延迟,在成年之前死亡率达15%-20%。基因疗法可能靶向这一疾病的生物学机制,从而改变疾病进程。然而,目前的AAV病毒载体无法装下SCN1A基因,而且基因疗法必须靶向特定细胞类型才能获得预期疗效。
因此,Encoded公司技术平台开发的基因疗法,能够有特异性地在受到疾病影响的GABA能抑制神经元(GABAergic inhibitory neurons)中,将SCNA1的表达水平恢复正常。临床前试验结果表明,接受一次治疗的小鼠不但GABA能抑制神经元中的SCN1A基因表达水平上升,而且对高热癫痫发作的敏感性获得了改善。
Encoded靶向控制基因表达的DNA片段,不是“剔除”有缺陷的基因,而是将新基因引入体内或用健康的拷贝替代有缺陷的基因。它的技术可以筛选并鉴定人类基因组中被称为“调控元件”的序列,因为它们控制着其他基因的表达。
亮剑银屑病!优时比创新疗法达到3期临床终点
优时比(UCB)公司今天宣布,其在研IL-17A/F抑制剂bimekizumab在治疗中重度斑块状银屑病成人患者的3b期临床试验中达到主要终点。与常用IL-17A抑制剂相比,bimekizumab在第16周和第48周时完全清除皮肤症状方面表现更优。这是这款IL-17A/F在第四项3期临床试验中获得积极结果。
当体内促炎症细胞因子和抑制炎症细胞因子的水平失衡时,会导致银屑病等慢性炎症疾病的持续发生。基于IL-12、IL-23/IL-17信号通路在释放促炎症细胞因子方面的关键性作用,这一信号通路成为治疗慢性炎症疾病的热门靶标。
Bimekizumab能够强力并特异性中和IL-17A和IL-17F。IL-17A在斑块型银屑病、银屑病关节炎和强直性脊柱炎的发病机理中起关键作用。IL-17A与IL-17F具有大于50%的结构同源性和重叠的生物学功能。IL-17A和IL-17F在多种发炎的人体组织中均上调,并与其他促炎细胞因子,例如肿瘤坏死因子(TNF)协同作用,放大炎症反应。同时结合这两种细胞因子,阻止它们与细胞表面表达的IL-17受体相互作用,能让bimekizumab更好地发挥抗炎症功能。
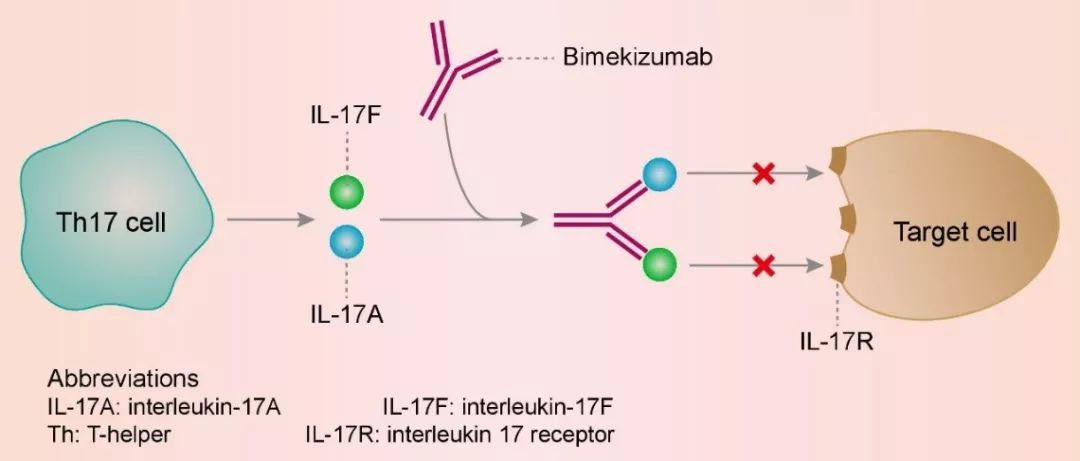
▲Bimekizumab的工作机理示意图(图片来源:Creativebiolabs.net)
在这项名为BE RADIANT的3期临床试验中,使用银屑病面积和严重程度指数100%改善(PASI 100)为指标,bimekizumab在第16周达到试验主要终点,与活性对照IL-17A抑制剂相比在完全清除皮肤症状方面显示出优效性。
同时,BE RADIANT研究也达到所有重要次要终点。Bimekizumab在第4周达到PASI 75和第48周完全清除皮肤症状方面优于活性对照组。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..