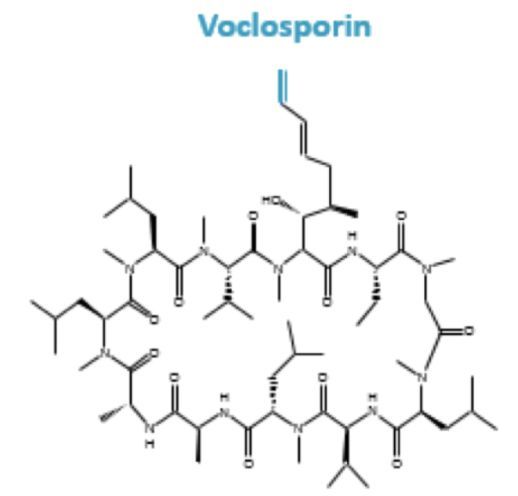
Aurinia Pharma是一家致力于开发肾脏病和自身免疫性疾病创新疗法的生物制药公司。近日,该公司宣布,美国食品和药物管理局(FDA)已受理voclosporin治疗狼疮性肾炎(LN)的新药申请(NDA),并授予了优先审查,处方药用户收费法(PDUFA)目标行动日期为2021年1月22日。FDA还通知该公司,目前不打算召开咨询委员会会议来讨论该NDA。此前,FDA已授予voclosporin治疗LN的快速通道资格(FTD)。
协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..