近日,Keytruda(pembrolizumab)被FDA批准扩展适应症,用于治疗不能通过手术或放疗治愈的复发/转移性皮肤鳞状细胞癌(CSCC)患者。这一批准,或将直接威胁赛诺菲/再生元Libtayo(cemiplimab-rwlc)在皮肤癌领域的地位。
CSCC是全球常见的皮肤癌之一,早期阶段可通过根治性手术或放疗治愈,但当CSCC侵入深层皮肤或邻近组织(局部晚期CSCC)或扩散到身体其他远端部位(转移性CSCC),临床治疗选择就非常有限。据历史数据,晚期CSCC患者(包括局部晚期和转移性CSCC患者)的预期寿命约为一年,亟需新的有效的治疗手段。
Libtayo也是一种针对免疫检查点受体PD-1(程序性细胞死亡蛋白-1)的全人单克隆抗体,2018年9月被FDA批准用于治疗不适合根治性手术或根治性放疗的局部晚期CSCC和转移性CSCC成人患者,成为美国市场中首个获得监管批准治疗晚期CSCC的药物。2019年7月,该适应症在欧盟被加速批准。据赛诺菲2020年Q1财报,Libtayo今年第一季度的销售额为12百万欧元。
此外,除了CSCC,Libtayo还被开发用于治疗其他癌种,如非小细胞肺癌(NSCLC)、宫颈癌、头颈部癌、前列腺癌、黑色素瘤、B细胞淋巴瘤等,其中针对宫颈癌和NSCLC的临床试验已经进展到III期阶段。
今年4月份,Libtayo在≥50%的肿瘤细胞中检测出PD-L1阳性的晚期NSCLC患者中开展的一项开放标签、随机、多中心III期试验达到总生存期(OS)主要终点。该研究旨在比较Libtayo单药疗法与含铂双药化疗用于一线治疗的疗效和安全性,由独立数据监测委员会开展的一项协议指定的中期分析表明:与含铂双药化疗相比,Libtayo将死亡风险降低32.4%。
而此次Keytruda CSCC适应症的获批是基于一项多中心、多队列、非随机、开放性II期试验KEYNOTE-629(NCT03284424)。数据显示:Keytruda表现出有意义的疗效和持久缓解,客观缓解率(ORR)为34%(95%CI:25-44)、完全缓解率(CR)为4%、部分缓解率(PR)为31%。在病情缓解的患者中,69%的患者缓解持续6个月或更长时间。中位随访9.5个月后,中位缓解持续时间(DOR)仍未达到(2.7-13.1个月)。安全性方面,CSCC患者的不良反应与Keytruda单药治疗黑色素瘤或非小细胞肺癌患者相似,常见的3-4级不良事件是淋巴细胞减少。
在此之前,Keytruda已被FDA批准20多个适应症,癌种覆盖NSCLC、SCLC、肾细胞癌、头颈部鳞状细胞癌、尿路上皮癌(UC)、膀胱癌、胃癌或胃食管交接癌、霍奇金淋巴瘤(HL)、宫颈癌、肝癌等,以及两个不限癌种的适应症--微卫星不稳定性高(MSI-H)/错配修复缺陷(dMMR)实体瘤和具有高组织肿瘤突变负荷(TMB-H)≥10个突变/Mb(使用FDA指定的检测)的无法切除或转移性实体瘤。
此外,近日Keytruda还被FDA批准单药一线治疗不可切除或转移性微卫星不稳定性高(MSI-H)或错配修复缺陷(dMMR)结直肠癌患者。这是Keytruda基于MSI-H或dMMR生物标志物首次获批的一线免疫疗法,是分子生物学标志物筛选患者方面的又一突破。
从上述信息可以看出,Libtayo和Keytruda已经在CSCC适应症上撞车,至于疗效谁更优,由于未做过头对头试验,目前还无法判断,但笔者估计Keytruda此次的获批会或多或少影响Libtayo在皮肤癌领域的地位,而且根据Libtayo适应症的开发,预计未来这两款药物会很快在UC、NSCLC撞车。
适应症不断增加,PD-1/L1混战激烈
PD-1/L1抑制剂是近年来研发火热的一类免疫疗法,截止目前,据insight数据库全球已经批准10款PD-1/L1单抗,详见下表,其中仅有度伐利尤单抗、阿替利珠单抗和阿维鲁单抗的作用靶点为PD-L1。
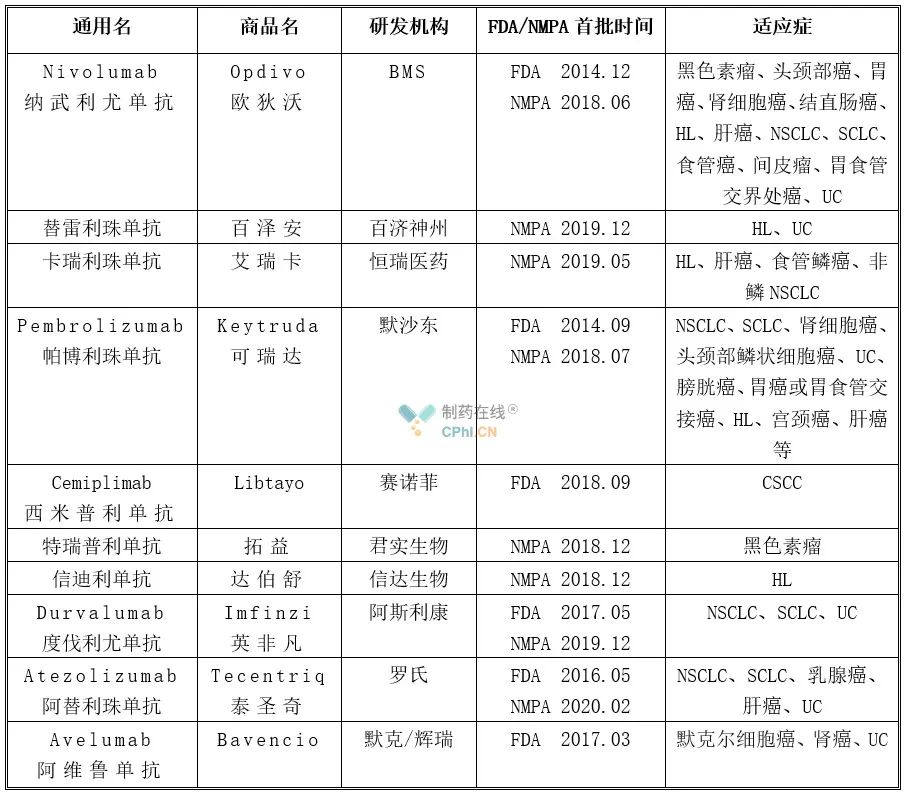
上述10款药物中,Keytruda的市场表现非常亮眼,获批适应症最多,全球销售额最高,2019年全球销售额首次突破百亿美元大关。销售额排名第二、第三、第四的分别是Opdivo、Tecentriq、Imfinzi,2019年的销售额分别为80.05亿美元、18.86亿美元、14.69亿美元。而Libtayo和Bavencio2019年销售额未查到,不过据公司财报Libtayo 2020年第一季度的销售额为12百万欧元,Bavencio 2018年全球销售额为69百万欧元,笔者猜测Bavencio2019年销售额高于Libtayo。而剩余四款国产PD-1单抗,由于仅在国内获批,销售额无法与上述四款进口PD-1/L1单抗相比,但达伯舒、拓益2019年的销售额分别为10.159亿元、7.741亿元,艾瑞卡2019年具体销售额未公布,业界估计突破10亿元,百泽安因获批较晚2019年未上市销售。
从上述表格中可以看出,已获批10款PD-1/L1单抗在适应症领域有交叉,尤其是在肺癌领域。而且上述药物还在不断开发新适应症,想必未来随着新PD-1/L1单抗的获批以及已获批PD-1/L1单抗对新适应症的探索,全球PD-1/L1市场势必有一场激烈的厮杀。
四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..