今日,美国FDA宣布,批准Viela Bio公司的抗CD19单克隆抗体Uplizna(inebilizumab-cdon)上市,治疗视神经脊髓炎谱系疾病(NMOSD)患者。这些患者体内携带靶向AQP4水通道蛋白的抗体。新闻稿指出,这是迄今为止,第二款获得FDA批准治疗这类患者的创新疗法。这也是Viela Bio公司成立以来首款获得FDA批准的创新疗法。该公司在2018年2月获得2.5亿美元A轮融资,从MedImmune独立而出,正式成立不到两年半,就收获了FDA批准的首款新药!
NMOSD是一种罕见的严重神经炎症性自身免疫疾病。80%的NMOSD患者对身体中名为AQP4的水通道蛋白产生自身抗体(autoantibody)。这些靶向AQP4的自身抗体主要与中枢神经系统的星形胶质细胞相结合,引发对视神经、脊髓和大脑中保护神经的髓鞘的攻击。患者出现的症状包括视力丧失、瘫痪、神经痛、甚至呼吸衰竭。每次NMOSD发作会给神经系统带来更多损伤并且造成患者残疾状况加重。目前还没有可以治愈这一疾病的疗法。
Viela Bio公司成立时的目标是靶向严重炎症疾病和自身免疫疾病中的共通信号通路。该公司的首席执行官姚正彬博士在接受药明康德内容团队采访时曾经指出,在80多种自身免疫疾病里,共通的信号通路非常普遍。所以,针对某一种疾病,如果你能开发出一款靶向特定信号通路的新药,它将有潜力在相关的疾病里也起到治疗效果。
Inebilizumab是一款对CD19具有高度亲和力的人源化单克隆抗体。CD19表达在多类B细胞上,其中包括分泌抗体的成浆细胞(plasmablasts)和浆细胞。通过与CD19抗原结合,inebilizumab能够迅速将这些细胞从血循环中清除,从而降低自身抗体的产生,缓解患者症状。这款创新疗法曾经获得了美国FDA授予的突破性疗法认定。
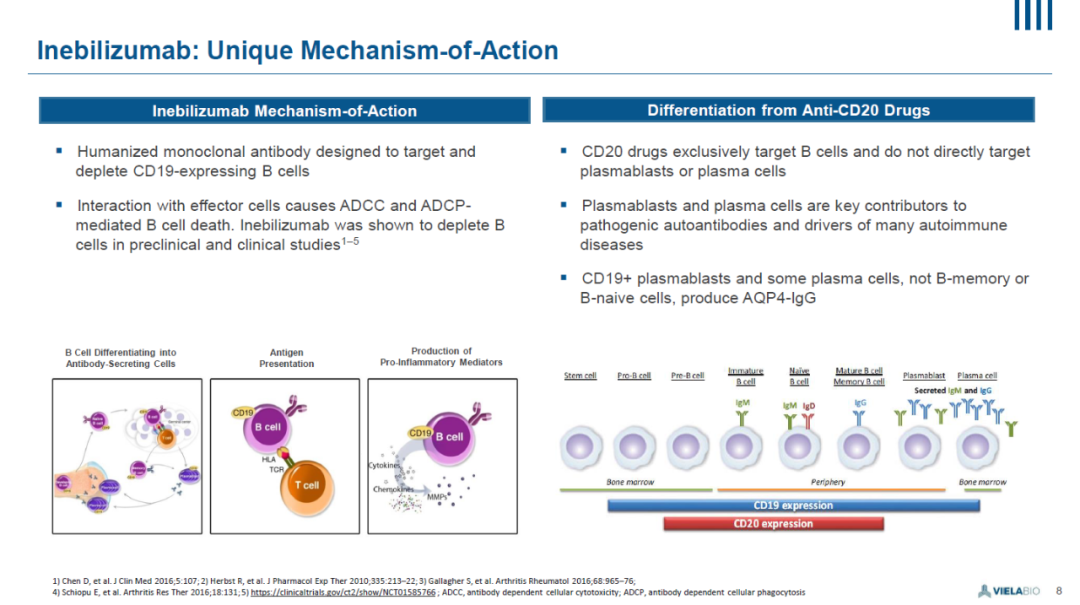
▲Inebilizumab简介(图片来源:参考资料[2])
这一批准是基于名为N-Momentum的关键性临床试验的结果。在这项研究中,230名患者随机接受了inebilizumab单药疗法或者安慰剂的治疗。这些患者包括213名AQP4抗体阳性的NMOSD患者。试验结果表明:
Inebilizumab达到试验的主要终点,在抗AQP4抗体阳性患者中,与安慰剂相比将NMOSD发作的风险降低77%(HR: 0.227; p<0.0001)。
在接受治疗6个月之后,89%的抗AQP4抗体阳性患者没有出现疾病发作,对照组的这一数值为58%。
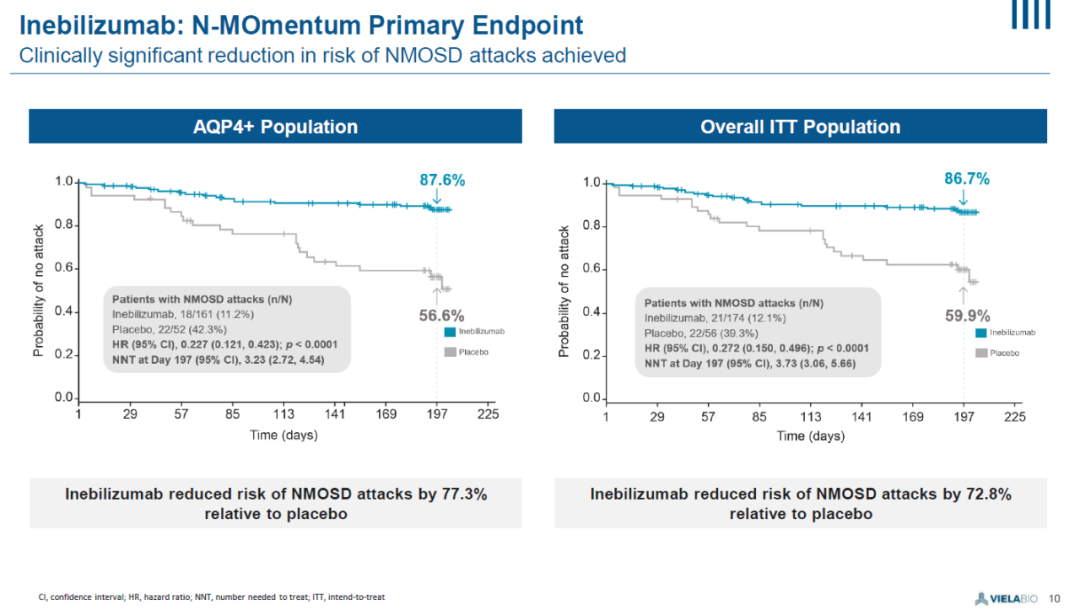
▲N-MOmentum临床试验主要试验终点数据(图片来源:参考资料[2])
鉴于B细胞分泌的自身抗体在多种其它疾病中也起到重要作用,Viela Bio公司已经向美国FDA递交IND申请,在重症肌无力和IgG4相关疾病患者中启动3期关键性和2b期临床试验,检验inebilizumab的效果。目前,该公司的研发管线中还有两款已经进入临床开发阶段的在研疗法。VIB4920旨在抑制CD40/CD40L共刺激通路,而VIB7734靶向先天细胞因子通路,抑制促炎症细胞因子的过度产生。
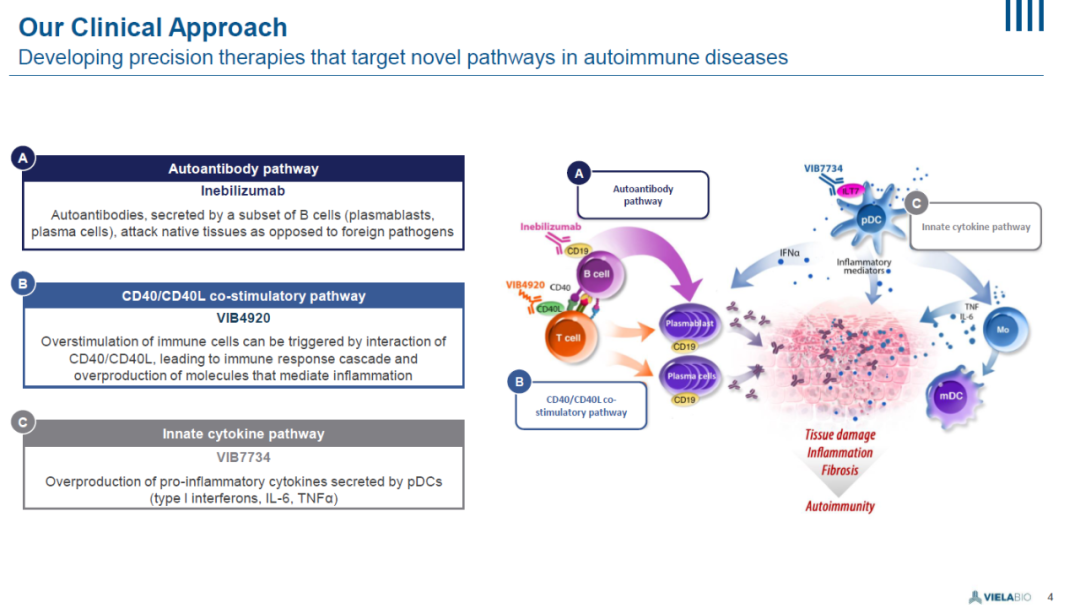
▲Viela Bio公司的临床开发策略(图片来源:参考资料[2])
2018年3月,姚正彬博士在接受药明康德内容团队专访时曾经说到,如果5年后,哪怕该公司研发管线中只有一款新药获批来到患者身边,对他们来说都是巨大的成功。我们祝贺Viela Bio提前达到这一里程碑,并且预祝他们再接再厉,开发出更多改变患者生活的创新疗法。

▲Viela Bio首席执行官姚正彬博士
四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..