药明康德内容团队编辑
儿童是我们的未来,但儿科用药却面临着独特的安全性挑战。近日,ICH通过S11儿科用药非临床安全性检测指导原则,提出“少用动物,多做试验”。
儿科用药非临床安全性检测指导原则如约而至
受新冠疫情影响,原定于今年4月在加拿大举行的ICH大会未能如期举行,但相关的ICH指导原则,仍然有条不紊地如期而至。4月14日,国际人用药品注册技术协调会(the International Council for Harmonisation,ICH)宣布通过S11指导原则(步骤4),该指导原则用于支持儿科用药非临床安全性检测。去年,ICH成员组织就该指导原则进行了磋商(步骤3)。

▲ICH指导原则(图片来源:参考资料[2])
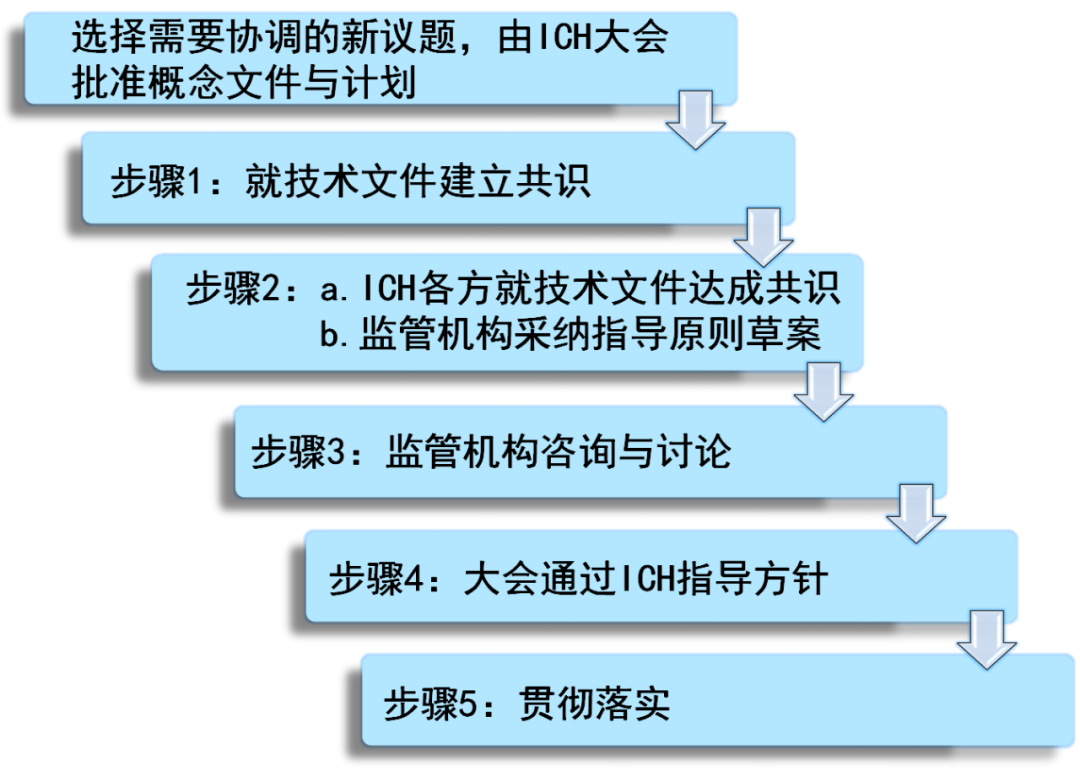
▲ICH指导原则制定、实施步骤(图片来源:参考资料[2])
减少对幼龄动物研究的需求
2014年,ICH指导委员首次确认将儿科用药非临床安全性指导原则列为议题,提出针对ICH合规国家的非临床儿科安全性检测的统一建议,目的是实现儿科临床试验,并依据实验动物3R原则,减少对幼龄动物研究(juvenile animal studies,JAS)的需求。实验动物人道主义3R原则,指减少(Reduction)、替代(Replacement)和优化(Refinement)实验动物的使用。4月14日公布的这份长达39页的指导原则,具体落实了ICH指导委员会提出的设想。
ICH表示,该指导原则将鼓励“理顺药物开发、提高科学严谨性,同时最大程度地减少不必要地使用动物。”依据S11指导原则,只有在既往的非临床和人体数据不足以支持儿科研究的情况下,才应开展其它非临床研究。
证据权重
ICH强调,与成人患者相比,儿科患者代表不同的人群,面临特有的安全性挑战。“儿童器官的不成熟,以及药物治疗过程中系统的成熟,会影响药物的药代动力学(PK)、药效学(DP)和药物的脱靶效应,可能导致安全性与疗效方面的差异。”
S11指导原则规定了证据权重(weight of evidence,WoE)方法,以确定支持针对儿科人群的药物临床开发所必需的非临床研究的程度。ICH表示:“需要设计适用、有效的非临床计划,对临床开发计划有通盘了解”。指导原则鼓励相关的医药公司早日考虑支持儿科用药的非临床研究。
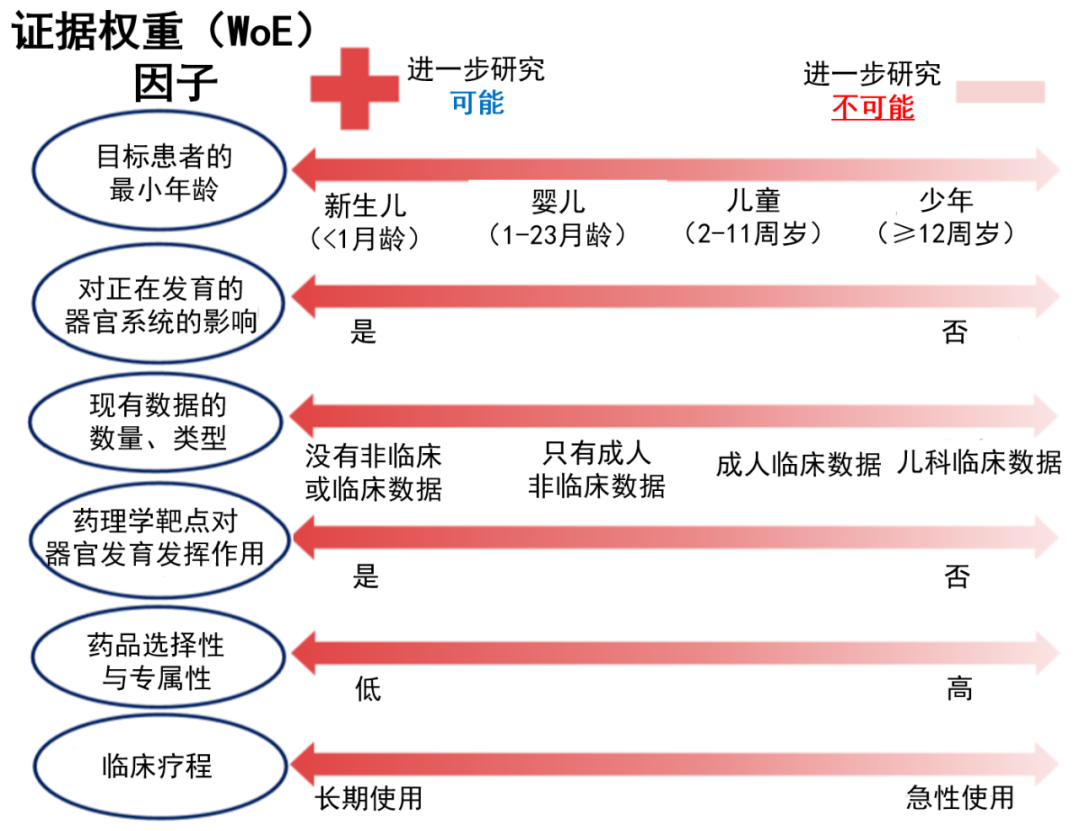
▲确定是否需要进行非临床研究时应考虑的关键WoE因素(数据来源:参考资料[1] 药明康德内容团队制图)
应高度重视上图中列于头两位的最重要因素,是拟定的目标患者最小年龄,以及在儿科试验期间,是否可能对患者的器官系统发育有不利影响。其它的证据权重因素,并未按照重要性顺序列出。在采用WoE方法的情况下,申办方应考虑可用于治疗的临床数据、药理特性、药代动力学数据和现有的非临床安全性数据。ICH表示,申办方应考虑开展其它动物研究的可行性,同时指出“某些终点可能并不适用于某些实验动物物种。”
S11指导原则还涵盖了非临床幼龄动物研究(JAS)设计的建议,以儿童为先/仅针对儿童的开发,以及评估辅料和复方药品对幼儿患者的安全性的考虑要点。
免责声明:本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。
参考资料:
[1] ICH HARMONISED GUIDELINE NONCLINICAL SAFETY TESTING IN SUPPORT OF DEVELOPMENT OF PAEDIATRIC PHARMACEUTICALS S11. Apr, 2020. Retrieved Apr 15, 2020 from https://database.ich.org/sites/default/files/S11_Step4_FinalGuideline_2020_0310.pdf
[2] 药明康德内容团队. 2020年 ICH指导原则将有哪些新进展?Nov 22, 2019. Retrieved Nov 22, 2019 from https://med.sina.com/article_detail_103_2_74467.html
[3] Michael Mezher. ICH adopts S11 guideline on nonclinical safety testing for pediatric drugs. Apr 14, 2020. Retrieved Apr 15, 2020 from https://www.raps.org/news-and-articles/news-articles/2020/4/ich-adopts-s11-guideline-on-nonclinical-safety-tes
[4] ICH. ICH S11 reaches Step 4 of the ICH Process. Apr 14, 2020. Retrieved Apr 14, 2020 from https://ich.org/news/ich-s11-reaches-step-4-ich-process
[5] ICH. Final Concept Paper S11: Nonclinical Safety Testing in Support of Development of Pediatric Medicines dated 3 September 2014 Endorsed by the ICH Steering Committee on 10 November 2014. Nov 10, 2014. Retrieved Apr 15, 2020 from https://database.ich.org/sites/default/files/S11_EWG_Concept_Paper.pdf
[6] ICH. S11 Nonclinical Safety Testing in Support of Development of Paediatric Medicines. Core Guideline. Sept, 2018. Retrieved Apr 15, 2020 from https://www.fda.gov/media/119756/download
[7] EMA. ICH guideline S11 on nonclinical safety testing in support of development of paediatric pharmaceuticals - Step 5. Jan 4, 2020. Retrieved Jan 9, 2020 from https://www.ema.europa.eu/en/documents/scientific-guideline/ich-guideline-s11-nonclinical-safety-testing-support-development-paediatric-pharmaceuticals-step-5_en.pdf
[8] NC3Rs. The 3Rs. Retrieved Apr 16, 2020 from https://www.nc3rs.org.uk/the-3rs
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..