3期试验提前收工!乳腺癌突破性抗体偶联疗法疗效显著
Immunomedics公司宣布,其抗体偶联药物sacituzumab govitecan在治疗转移性三阴性乳腺癌(mTNBC)患者的3期试验ASCENT中表现出优异的疗效。经独立数据监督委员会(DSMC)的审查,最终一致建议提前结束这一试验。目前,美国FDA正在重新审评该药物的上市申请,预计将于今年6月做出回复。新闻稿指出,sacituzumab govitecan有望成为首款获得FDA批准用于治疗mTNBC的抗体偶联药物。
Sacituzumab govitecan是一款将靶向TROP-2的抗体与化疗药物伊利替康(irinotecan)的活性代谢物SN-38连接构成的抗体偶联药物。TROP-2是在多种人类肿瘤中过度表达的细胞表面受体。它能够通过与TROP-2蛋白相结合,将化疗药物伊利替康的活性代谢物递送到癌细胞内部。今年2月,美国FDA已授予sacituzumab govitecan突破性疗法认定,用于治疗mTNBC患者。
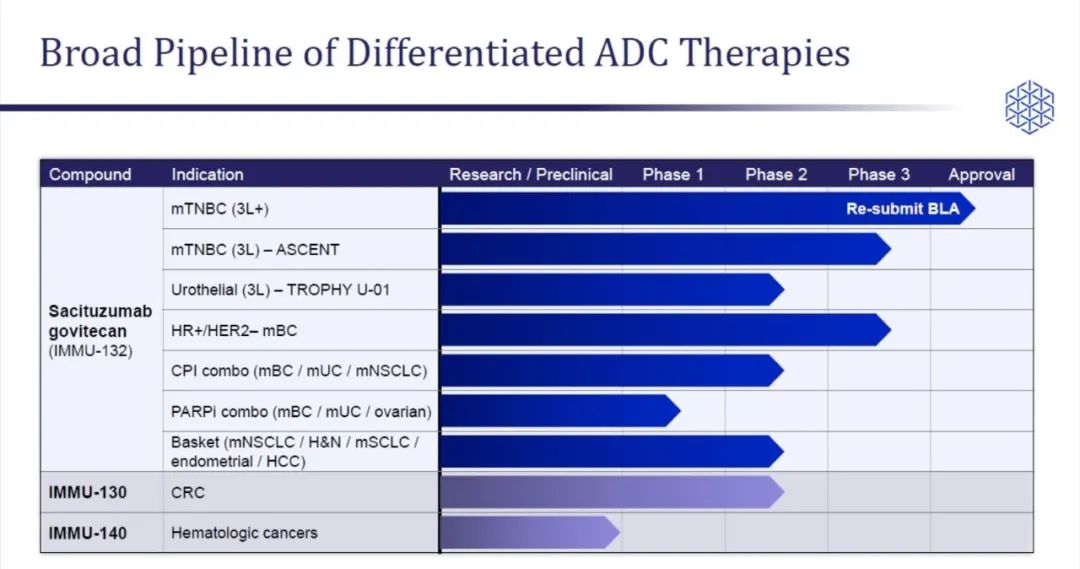
▲Immunomedics研发管线(图片来源:Immunomedics官网)
ASCENT是一项3期验证性研究,旨在验证sacituzumab govitecan在治疗经过多种前期疗法治疗的mTNBC患者时的安全性和有效性数据。该研究的主要终点是患者的无进展生存期(PFS),次要终点包括总生存期(OS)和客观缓解率(ORR)等。
剑指特定非小细胞肺癌!武田ALK抑制剂首次获批扩展适应症
武田公司(Takeda)宣布,欧盟委员会(EC)批准了其ALK抑制剂Alunbrig(brigatinib)扩展适应症,作为单药疗法一线治疗未经ALK抑制剂治疗的ALK阳性晚期非小细胞肺癌(NSCLC)成人患者。
Alunbrig是武田开发的下一代酪氨酸激酶抑制剂(TKI),它的设计有针对性地靶向和抑制ALK融合蛋白。在2017年4月,它获得FDA的加速批准,二线治疗ALK阳性转移性NSCLC患者。这些患者在接受crizotinib治疗之后疾病继续进展。
此次批准是基于名为ALTA-1L的随机、多中心、3期临床试验的积极结果,该试验在既往未接受过ALK抑制剂治疗的ALK阳性局部晚期或转移性NSCLC患者中评估,与克唑替尼(crizotinib)相比,Alunbrig的安全性和疗效。
试验结果显示,与克唑替尼相比,Alunbrig具有显著的优越性,它在脑转移患者亚组中观察到了显著的抗肿瘤活性。根据独立审查委员会(BIRC)的评估,经过两年多的随访,Alunbrig使脑转移瘤患者的颅内疾病进展或死亡风险降低69%。根据研究者的评估,它使脑转移瘤患者的疾病进展或死亡风险降低76%。此外,Alunbrig还在意向治疗组中显示出一致的总体疗效,根据BIRC的评估,Alunbrig治疗组中患者的中位无进展生存期(PFS)比活性对照组长2倍以上,分别为24个月和11个月。根据研究者的评估,这一数值分别为29.4个月与9.2个月。
降低NASH患者肝脏炎症指标!Namodenoson达到2期临床终点
Can-Fite BioPharma公司宣布,其A3腺苷受体激动剂namodenoson在治疗非酒精性脂肪性肝病(NAFLD)和非酒精性脂肪性肝炎(NASH)患者的2期临床试验中,能够剂量依赖性地降低患者的血清丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)水平,达到了研究的主要终点。
Namodenoson是一种口服药物,它可以选择性地与A3腺苷受体(A3AR)结合。A3AR在炎症和癌细胞中高度表达,而在正常细胞中的表达很低。Namodenoson已在2项2期试验中评估了其治疗肝细胞癌(HCC)和NAFLD/NASH的疗效。目前,它已获得美国和欧洲监管机构授予的孤儿药资格。
这项2期、双盲、含安慰剂对照组的研究旨在评估namodenoson在治疗NAFLD和NASH患者中的疗效与安全性。患者共接受12周治疗,并随访至第16周。该研究的终点包括ALT和AST水平的变化、肝脏脂肪百分比、肝脏硬度等。试验结果显示,与安慰剂组相比,患者的ALT和AST水平呈剂量依赖性降低,表明了肝脏炎症的减轻。第16周随访时,25 mg剂量组中ALT恢复正常水平的患者百分比为36.8%,12.5 mg剂量组中的这一数字为23.8%,而安慰剂组中的这一数据仅为10%。
联手Second Genome!吉利德开发炎症性肠病微生物组疗法
吉利德科学(Gilead Sciences)和Second Genome公司联合宣布,两家公司已经达成了一项为期4年的战略合作协议,共同确定与吉利德科学研发管线中5种在研疗法的临床应答相关的生物标志物,并开发治疗炎症性肠病(IBD)的潜在新靶点和候选药物。
Second Genome致力于通过对人体微生物组的了解和分析,确定生物标志物、生物途径、靶点和潜在的治疗方法。其专有的微生物组发现平台(Microbiome Analytics Platform)通过将计算科学和机器学习,与人类疾病生物学相结合,以重新定义疾病。它建立了专有的结构化数据库,以生成在传统药物发现和开发中用于筛选药物的化合物库,解决靶点发现和验证中的局限。
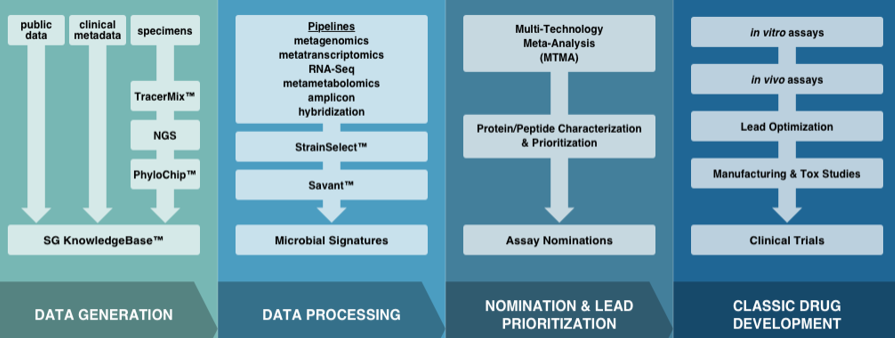
▲Second Genome开发平台(图片来源:Second Genome官网)
根据协议条款,Second Genome将利用其专有的微生物组分析平台鉴定与吉利德试验性药物临床应答相关的新型生物标志物。这项工作将利用微生物组学的最新见解帮助细分患者,并在未来优化患者的潜在疗法。该平台还结合了其它的工具来寻求与IBD相关的新靶点和候选药物。这将包括在未来4年内确定多达5个新的IBD治疗靶点或候选药物,并可选择将合作再延长两年。
Second Genome将获得3800万美元的前期付款,和高达约3亿美元的潜在里程碑付款,以及就所开发药物在未来的销售额分成。吉利德将拥有5个开发项目在全球范围内的选择权,以及在合作中开发的所有生物标志物的专有权。
靶向RNA!罗氏和Arrakis合作开发小分子疗法
Arrakis Therapeutics公司宣布与罗氏达成一项战略合作和许可协议,针对罗氏所有研究领域的广泛靶点,共同开发靶向RNA的小分子药物。
Arrakis正在采取多种方法,针对RNA生命周期的多种机制建立小分子药物发现的新范式。该公司的发现平台集成了前沿的RNA生物信息学和结构工具,精选的化学文库,RNA特异性检测,以及RNA导向的药物化学。除了与合作伙伴的合作,Arrakis公司还在开发内部的研发管线,用于治疗癌症和其他严重疾病。在这些疾病的治疗中,该公司已经确定了具有挑战性的有效靶点和疾病驱动因素。
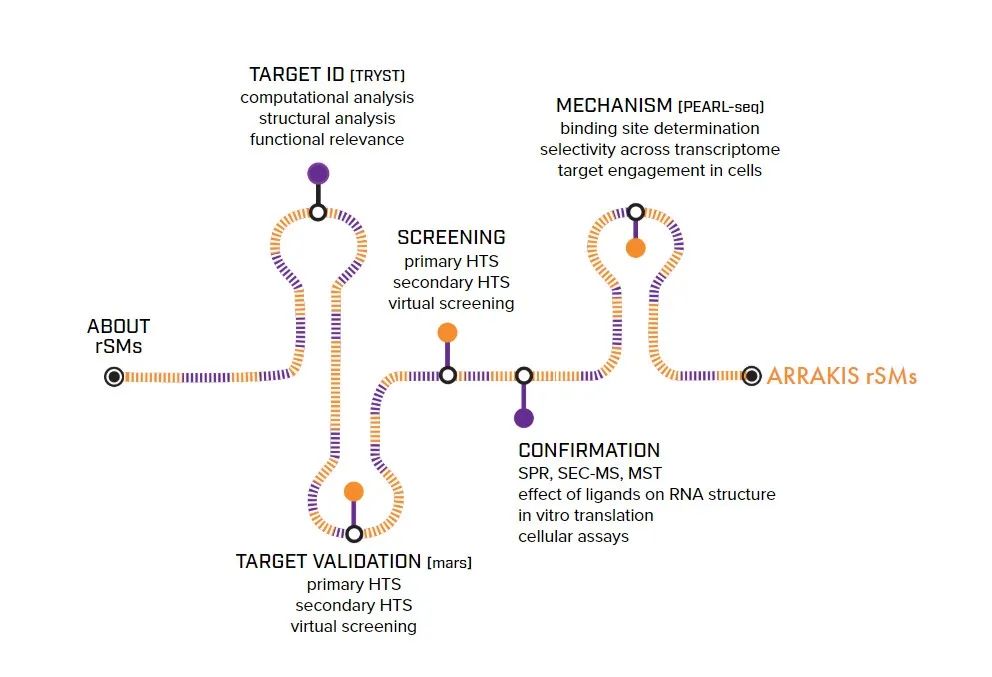
▲Arrakis靶向RNA的小分子药物平台示意图(图片来源:Arrakis授权使用)
根据协议条款,Arrakis公司将领导每个靶点的发现和研究活动,届时罗氏将有权从事进一步的临床前和临床研究。Arrakis公司将有资格获得1.9亿美元的前期付款以及可高达数十亿美元的潜在里程碑付款,以及就合作开发的产品在未来的销售额分成。
膀胱癌患者迎来新希望!德国默克、辉瑞PD-L1抑制剂获突破性疗法认定
德国默克(Merck KGaA)与辉瑞(Pfizer)公司共同宣布,已向美国FDA递交其联合开发的PD-L1抗体Bavencio(avelumab)的补充生物制品许可申请(sBLA),作为一线维持疗法治疗局部晚期或转移性尿路上皮癌(UC)患者。同时,FDA还授予该疗法突破性疗法认定,并决定将使用实时肿瘤学审评(RTOR)试点项目进行审评。
Bavencio是德国默克与辉瑞共同开发的全人源化PD-L1单抗,通过结合PD-L1,它可以防止癌细胞使用PD-L1来逃避免疫细胞的抗肿瘤反应,激活T细胞参与杀伤肿瘤。Bavencio已获得FDA批准用于治疗转移性默克尔细胞癌(MCC),和接受过化疗的局部晚期或转移性UC患者。
该项申请的递交是基于3期临床试验JAVELIN Bladder 100获得的积极结果。该试验是一项随机、多中心的临床研究,共有700名已接受过诱导化疗,且疾病未出现进展的局部晚期或转移性UC患者参与其中。患者被随机分配分别接受Bavencio与最佳支持护理(BSC)构成的一线维持疗法,或BSC的治疗。试验结果表明,与BSC治疗组相比,Bavencio联合疗法显著延长UC患者的总生存期(OS),达到试验的主要研究终点。该试验的详细数据将在未来的医学会议上公布。
造福神经纤维瘤病患者!首款FDA批准药物疗法问世
美国FDA宣布批准阿利斯康(AstraZeneca)公司和默沙东(MSD)公司共同开发的Koselugo(selumetinib)上市,治疗2岁及2岁以上的1型神经纤维瘤病(NF1)儿童患者,这些患者携带有表现出症状和/或进行性,不能通过手术治疗的丛状神经纤维瘤(PN)。新闻稿指出,Koselugo是首款获得FDA批准治疗这种在生命早期就使人衰弱的罕见疾病药物。
MEK是RAS/MAPK信号通路中的关键蛋白激酶。Koselugo能够选择性地抑制MEK1和MEK2,从而让失调的信号通路恢复正常,进而缓解儿童NF1患者的病情。此前,Koselugo已得到FDA授予的孤儿药资格、突破性疗法认定和优先审评资格,适应症为治疗NF1。
Koselugo的获批是基于其在美国国家癌症研究所开展的一项临床试验研究结果,参与该试验的NF1儿童患者携带无法通过手术治疗的丛状神经纤维瘤。试验结果显示,Koselugo的治疗使患者的总缓解率(ORR)达到66%,所有患者均为部分缓解,这意味着没有患者的肿瘤完全消失。在这些患者中,82%的患者缓解持续时间达到了12个月或更长。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..