▎药明康德内容团队编辑
今日,默沙东(MSD)公司宣布,美国FDA接受了该公司为重磅PD-1抑制剂Keytruda递交的第二项“不限癌种”补充生物制品许可申请(sBLA)。这一申请寻求加速批准Keytruda,治疗肿瘤突变负荷高(TMB-H)的不可切除或转移性经治实体瘤患者。FDA同时授予这一申请优先审评资格,预计在今年6月18日之前做出答复。
此前,FDA已经批准Keytruda作为“不限癌种”疗法,治疗微卫星不稳定性高(MSI-H)或错配修复缺陷(dMMR)实体瘤患者。然而MSI-H只是携带TMB患者的一小部分。如果这一申请获批,它不但可能显著扩展Keytruda单药疗法治疗的患者群体,而且标志着TMB作为一种筛选患者的分子标志物,得到了FDA的认可。
什么是肿瘤突变负荷?它对癌症免疫疗法的患者筛选有什么影响?在今天这篇文章里,药明康德内容团队将帮助读者回答这些问题。

寻找适于免疫检查点抑制剂疗法的患者
以PD-1/PD-L1抑制剂为代表的免疫检查点抑制剂的出现,是癌症治疗历史上的重大突破。这些癌症免疫疗法,通过抑制对患者体内T淋巴细胞的抑制作用,让T淋巴细胞能够更有效地杀伤肿瘤。自从首款检查点抑制剂获批以来,这类药物在多种癌症类型中已经表现出显著的疗效。
然而,并不是所有癌症患者都能够对检查点抑制剂疗法产生响应。如果不对患者进行筛选,大约只有20%的患者对检查点抑制剂单药疗法产生响应。检查点抑制剂的作用被喻为“去掉免疫系统的刹车“,但是免疫系统要对肿瘤进行攻击,第一步需要对肿瘤产生免疫反应。有些肿瘤激发免疫反应的能力(免疫原性)不强,这些肿瘤也被称为”冷“肿瘤。检查点抑制剂对这些”冷“肿瘤的效果并不好。
因此,除了扩展检查点抑制剂的适用范围以外,如何更有效地找出能够对检查点抑制剂产生响应的患者也至关重要。毕竟,在与癌症进展赛跑的治疗过程中,使用无效的疗法不但给患者带来不必要的负担,而且延误他们接受有效疗法治疗的时间。目前,筛选对PD-1/PD-L1抑制剂疗法产生响应的办法主要是检测肿瘤细胞表达的PD-L1水平。然而,这一检测并没有检测肿瘤免疫原性,它检测的是肿瘤是否使用PD-L1来逃避免疫系统的攻击。沿用“去掉免疫系统的刹车“的比喻,检查PD-L1水平是在检测肿瘤是否使用了PD-L1这个”刹车“。
研究人员仍然需要一种检测方法来确定肿瘤的免疫原性,而肿瘤突变负荷是决定免疫原性的重要因素之一。
肿瘤突变负荷和免疫原性的关系
我们知道,癌症的发生是由于癌细胞的基因组中不断积累基因突变,最终导致细胞癌变。基因突变不但能够导致调节细胞分裂的机制出现功能失常,从而引发细胞不受控制地增生,而且这些突变的基因会产生与健康细胞不一样的蛋白。这些蛋白会被人体的免疫系统发现,从而产生免疫反应。这些由于基因突变,在肿瘤细胞上出现的与健康细胞不同的抗原称为“新抗原“。它们是决定肿瘤免疫原性的关键因素之一。而肿瘤细胞编码蛋白的区域(外显子)出现的基因突变越多,产生新抗原的可能性越大,肿瘤的免疫原性也可能越强。
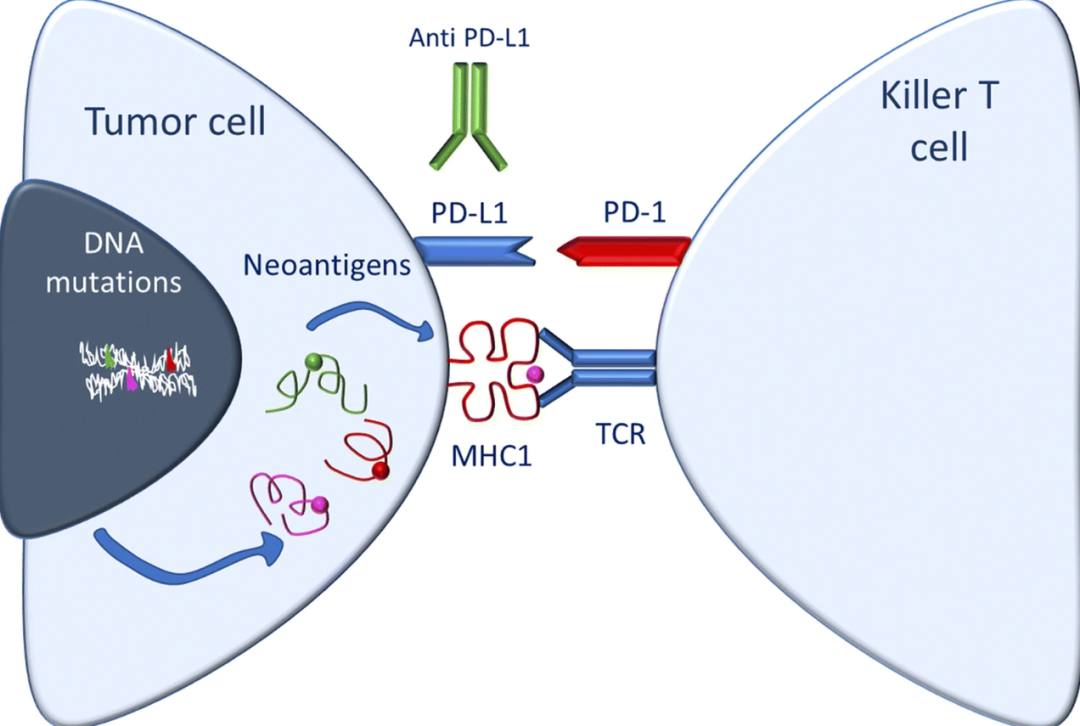
▲肿瘤突变负荷与免疫原性的关系(图片来源:参考资料[5])
2017年,Keytruda首次获得FDA批准治疗微卫星不稳定性高(MSI-H)或错配修复缺陷(dMMR)的实体瘤患者。MSI是由于错配修复缺陷,导致DNA的特定区域出现非常多的基因突变。MSI-H的患者对PD-1/PD-L1抑制剂的响应比例显著提高,达到约50%。然而,除了结直肠癌和子宫内膜癌以外,其它癌症类型中出现MSI-H的比例并不高,因此使用MSI-H对患者进行筛选,能够影响到的患者人数并不多。
以往的研究表明,在TMB-H的患者中,同时出现MSI-H的患者比例在15%~40%之间(如何定义TMB-H对这一数值影响很大),因此如果能够使用TMB-H作为筛选癌症患者的分子生物标志物,那么检查点抑制剂就可能造福更多患者。
TMB对检查点抑制剂疗效的预测能力
癌症患者的TMB状态对检查点抑制剂疗法疗效的影响已经在多项研究中得到检验。总体来看,TMB-H的患者对检查点抑制剂的响应率提高,患者的无进展生存期(PFS)也得到提高(见下表)。然而,也有临床试验发现TMB状态对检查点抑制剂疗法的疗效的影响不明显,在总生存期(OS)终点上的表现不佳。

以默沙东递交这一申请基于的KEYNOTE-158临床试验为例,在这项试验中,不同类型的经治转移性实体瘤患者接受Keytruda单药治疗。TMB-H患者的总缓解率(ORR)为30.3%,包括4%完全缓解和26.3%部分缓解。而在非TMB-H患者中,ORR为6.7%。在一年后,TMB-H患者中无进展生存率为26.4%,而非TMB-H患者中,无进展生存率为14.1%。
而在总生存期(OS)方面,TMB-H患者的中位OS(11.7个月)反而短于非TMB-H患者(13.0个月)。这里值得注意的一点是TMB-H患者携带的肿瘤由于基因突变更多,可能进展更快或更具有侵袭性,从而导致患者预后比非TMB-H患者更为不良。
设定TMB检测的标准
TMB检测通常使用下一代基因测序技术(NGS)完成,最初,对TMB的检测依靠对癌细胞的全外显子组测序(WES)。这一检测方法虽然能够全面衡量癌细胞的基因突变负荷,但是成本相对较高,一定程度上也影响了它的广泛使用。而另一种方法是对癌细胞基因组中有代表性的特定基因进行测序,以它们的基因突变负荷作为全外显子组的替代指标。以默沙东递交的这一申请为例,它使用的是Foundation Medicine公司开发的Foundation ONE CDx分子测试。这一测试只对324个基因中出现的变异进行了超深度的NGS检测。然而,不同厂家开发的分子测试挑选的基因也不一样,哪一组基因组合能够最好地反映癌细胞基因组的TMB仍然是研究人员需要解决的问题。
图片来源:Foundation Medicine公司官网
另一个重要因素是如何确定TMB-H的阈值。默沙东的这一申请中,将TMB-H定义为每百万个碱基对中出现基因突变数目大于10个(>10/megabase)。然而其它公司在进行临床试验时对TMB-H的定义与这一标准并不一致(见上面的表格)。这也会限制TMB作为分子生物标志物在临床使用中的推广。
从这个角度上说,默沙东的这一申请有望促进对TMB检测手段和TMB-H标准的确立。如果FDA认可默沙东申请中的TMB检测手段和TMB-H标准,将为其它医药公司开发基于TMB的治疗手段设下重要的标杆。
在个体化疗法的时代,医生的目标是通过对患者进行更深入的分析,找到最适合他们的疗法。Keytruda这一“不限癌种”申请获得优先审评,是TMB成为个体化疗法的生物标志物的重要一步。我们期待业界进一步完善和标准化TMB检测,让更多患者能够通过预先筛选,找到最适合他们的治疗方法。
题图来源:123RF
参考资料:
[1] Merck Receives Priority Review from FDA for Second Application for KEYTRUDA® (pembrolizumab) Based on Biomarker, Regardless of Tumor Type. Retrieved April 7, 2020, from https://www.businesswire.com/news/home/20200407005141/en
[2] FDA Grants Pembrolizumab Priority Review for TMB-High Tumors. Retrieved April 7, 2020, from https://www.targetedonc.com/news/fda-grants-pembrolizumab-priority-review-for-tmbhigh-tumors
[3] FoundationOne®CDx Technical Information. Retrieved April 7, 2020, from https://assets.ctfassets.net/vhribv12lmne/6Rt6csmCPuaguuqmgi2iY8/629ba4e5c7d9a3bd1f1f666085e1e4b1/FoundationOne_CDx_Label_Technical_Info.pdf
[4] Chan et al., (2019). Development of Tumor Mutation Burden as an Immunotherapy Biomarker: Utility for the Oncology Clinic. Annals of Oncology, DOI: 10.1093/annonc/mdy495
[5] Galuppini et al., (2019). Tumor mutation burden: from comprehensive mutational screening to the clinic. Cancer Cell International, https://doi.org/10.1186/s12935-019-0929-4
[6] FDA's new Keytruda review is step for genetic medicine, immunotherapy. Retrieved April 7, 2020, from https://www.biopharmadive.com/news/fda-keytruda-tissue-agnostic-genetic-medicine/575623/
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..