去年9月,综合审评实施后,新药批准卷宗提供的所涉信息将会有所减少的报道,引起各界的广泛关注。近日,FDA新药办公室主任Peter Stein医生在接受采访时,纠正了当时的不准确传达。
FDA新药办公室(Office of New Drugs,OND)主任Peter Stein医生,日前在FDA在白橡树园区接受业界知名的专业媒体Regulatory Focus的采访。在采访中,Stein主任讨论了近几个月来,FDA受到的一些批评。这些批评,涉及药品批准速度,以及可能存在批准标准降低等。同时,Stein医生还针对去年12月获批的用于治疗杜氏肌营养不良症的Vyondys 53(golodirsen)注射剂,阐述了相关问题。Stein医生还对一些问题做出回应,包括是否可以采取更多措施,加快确认性临床试验,加快批准速度。以及在改进透明度,在新药办公室重组方面,所采取进一步举措。

▲FDA新药办公室主任Peter Stein医生(图片来源:FDA官网)
问:最近几个月,有一些报道,涉及到FDA如何依据较少的临床证据,批准了更多药品;以及允许在没有对照组的情况下,开展更多的临床试验,作为新的证据。您是否认同相关报道的观点?在FDA内部,对这种明显转变,是否有所担忧?
Stein医生:我认为,真正的答案在于,大家应该考虑到,我们如何针对所面临的实际情况,正在监管的药品,以及提交批准申请的药品,来做出决策。简言之,答案是“否”,大家并没有考虑到上述的各种具体情况。我认为, 我们的标准,并没有变化。当大家审视类似申请时,没有证据表明,与几十年来我们一直的要求相比,现在有什么不同。尽管一些工具有些变化,但是,当您审视能够符合我们标准的要求时,我认为,并没有改变。如果大家回顾20年前,并与过去几年的情况相比较,就会看到,我们当时着手应对常见慢性病,诸如慢阻肺(COPD)、哮喘、糖尿病、高血压和偏头痛的药品。如果大家回顾过去几年,仍然看看一些治疗慢性病的药品,但即便在这些领域,即便之前有药可用,也往往存在一些亚组和人群,存在治疗不足(undertreated)的情况。而我们现在看到的是,罕见病治疗药物,有了大幅度增长。
这是实实在在的改变,非常显著的改变,在癌症治疗药物数量方面,尤其是针对我们已经认定了分子机制的癌症亚型和罕见癌症的药物,今非昔比。但是,大家会问,对于这些类型的药物,是否需要视具体情况,具体考虑,我们是否使用了更多的单臂、历史对照试验?确实如此,那是因为,我们正在着手应对更为罕见的疾病。
如果大家看看20年前的同类药物,比较不同时期的同类药物,是否有所不同?我的看法,是否定的。在针对这些类型药物的相关程序适用的情况下,我们现在接受较小的程序,更多的单臂试验。如果大家将苹果与苹果相比较,而不是将苹果与橘子相比较,那么我认为,从做出批准决定的批准卷宗,大家可以看出,并不存在实质差异。

图片来源:Pixabay
举例来讲,如果对于一种分子机制已经明晰的罕见癌症,对于以相关分子机制为靶向的药物,我们已经获得显著的响应(response),与历史对照中发现的响应截然不同。针对这类药物,如果具有非常有说服力和令人信服的实例,对患者有意义和非常重要的获益,就没有进行随机化试验的必要。
重要的是,大家需要认识到,我们一直在应对不确定性。对于罕见病,大家所关注的,是进行性、严重和最终足以致命的疾病;对于这样的疾病,患者和医生愿意接受更多不确定性。在亟需治疗的患者面前,我们究竟可以接受多少不确定性?这始终需要加以平衡。我们不希望带给大家不切实际的希望,我们所希望的,是设法找到答案,同时接受一些不确定性。当然,在这样的情况下,我认为,这样的做法,符合我们的法规。
问:对于不确定性,在批准Sarepta公司的杜氏肌营养不良症治疗药物golodirsen时,引起了一些争议。在此,您是否愿意阐述相关的完全回应函(complete release letter)中提出的一些问题?
Stein医生:我将会在可以公开下载的在线信函中详细阐述。我认为,必须指出: 我们并不排斥分歧。通过求同存异,允许和合理接受科学观点上的差异,有助于做出尽可能最好的决定,但最终必须做出决策。相关的审评部门做出了一个决定,作为科学家,我尊重(负责审评的新药办公室药品审评部负责人)Ellis Unger医生所做出的不同的决定;然后,我审查了这一决定,并做出不同的决定。
对于这些决定,我们各自都有具体的理由。当大家审视罕见病和亟需患者时,相关的数据集,极具挑战性。

图片来源:Pixabay
在此,我要讲的是,对我来说,重要的是,这家公司实际上将能够取得进展,开展研究。正如我在相关的回应函中所指出的那样,Sarepta公司正在开展研究,在患者招募方面,进展非常顺利。对我而言,作为整个范式的一部分,我们希望在合理的时间内,尽快地获得更为稳健可靠的临床数据,来验证和确认,我们确实看到了大家所希望看到的获益。对我来说,了解到相关的临床试验正在进行,并且有足够的把握度评价相关问题,这些很重要。接受不确定性,并不等同于不加约束地允许不确定性。我们接受某些不确定性,但是我们希望看到正在进行的试验,使得我们能够确认,确实有获益。大家可能还看到,我曾要求Sarepta公司,确认他们了解,相关的临床试验将寻求什么样的获益;如果我们不能认定相关的获益,那么,相关药品应予退市。
这些很重要,但这并非没有约束、无休无止的决定。随着相关进展,我们将获得更多信息,以便做出更为细致的决策。
问:FDA能够做些什么,来确保获得药品加速批准的公司,按时完成相关的确认性研究?对于超出确认试性临床试验期限的情况,您是否认为,会对相关医药公司处以罚款?
Stein医生:我们现在正在加以研究,这很重要。对于golodirsen这一具体药物,这确实很重要。 我认为这应该成为规则,我们应该就该尽力而为,确保能够提出一个可行、具备可操作性的试验,在合理的时间内,获得相关信息。但知易行难,有时,会比我们所能够想象的更具挑战性,耗时更长。
在癌症治疗药物领域,已有可资借鉴的经验,不乏在合理的时间限内,显示出相当高的确认率的实例。我们是否能够再做些什么?我们正在研究这一问题,以便优化与申办方的互动,切实可行地开展的各种试验,并且,我们将监控这些试验。我想强调,我们不希望批准一个药品之后,没有我们需要的后续数据。
我无法推测是否会予以罚款,但我们将研究现有的工具,了解如何与公司更好地合作,以开展研究。我认为,最好从一个能够实际解决问题的位置开始,这样的位置应该可行,能够保证与公司密切合作,确保相关的临床试验设计,可以回答我们所提出的问题。这将会是一个更好的过程,我们能够仔细监控,确保相关的医药公司能够履行承诺,开展确认性临床试验研究。

图片来源:Pixabay
问:您认为,FDA在哪些方面可以更加透明?去年秋天,在RAPS Convergence大会上,您在演讲中谈到,利益攸关方如何从FDA公布的批准卷宗(approval package)中,检索某些数据。根据一项新的计划,获取某些信息,将涉及到《信息自由法案》(the Freedom of Information Act FOIA)。这项新计划进展如何?
Stein医生:我认为,我在那次大会上的讲话中,我误解了这个问题。当时我所讲的,并不正确。在以前的批准卷宗中的所有内容,都将在新的卷宗中提供。仍然有可能像现在这样,依据《信息自由法案》进行补充,但这些卷宗的篇幅会变小。 原因在于,我们确实减少了重复,但是该卷宗的所有要素,在批准卷宗中都将会所体现,予以提供。因此,对于希望查询数据,或研究我们的分析和决策的用户来讲,可用的内容,将不会有任何显著差别。

图片来源:Pixabay
新的综合审评另外一个部分,对问题进行重点讨论,并提供全面的评价,并附有附录,其中有很多图表和数字,这些图片和数字,不如我们放在第一部分中的那么重要。大家所检索的内容将可用,我认为,在去年的会议上,我并没有传达准确。的确,相关的篇幅,确实更少,原因在于,我们已经消除对流程设计的每个回顾,不再事无巨细地包揽,加倍提高了效率,删繁就简,保留了大家之前通过批准卷宗检索的信息。
我们有团队开展了综合审评,我们完成了一些工作,这是一项正在进行中的工作。我们正在研究他们贯彻落实我们的目标情况,即更清楚地了解,关键问题究竟是什么。我们以及患者和医生,将有更大的清晰度,了解我们对每个应用程序的考量。我认为,在综合审评中,我们将会更加透明,将预先明确问题,并标记出讨论有效性,或是安全性问题的相应部分。我认为,将会更清楚。新的流程,包括更多的团队互动,以及与负责处理这些问题的管理层和工作组的讨论。我认为,大家将会发现,大家所看到的内容,将能够对我们的考量和分析,有更为深入的了解,而不是仅仅是单个的审评。

图片来源:Pixabay
我要强调的一件事,是 我们接受不同意见。 我认为, 在我们的流程中,我们之间存在站得住脚的科学上的不同意见,这确实很重要。而这个新模板,绝不会扼杀这一点。我们中间,并不是所有人都同意结论,能够将不同的意见摆到桌面上,然后我们确保团队能够解决分歧。我们必须做出决定和评价,但是我们希望,能够接受意见分歧。
问:您能否谈谈新药办公室(OND)重组对其自身有何帮助?
Stein医生:我确实希望退一步说,我们正在实施的现代化计划,实际上不只是重组。我们正在研究很多流程,例如新药批准(NDA)和生物制品许可批准(BLA)申请审评(集成审评)。这是一项持续的工作流程,我们正在研究,我们如何进行30天的新药临床研究申请(IND)默示许可。我们正在研究上市后工作流程,将更多信息放入IT系统,以及有关人才和专业发展的工作流程。
相关重组的目的,实际上是为了使新药办公室(OND)在治疗上更加统一,并使部门的规模更合适。因此,当我就任新药办公室主任时,确实有一些部门,非常庞大,职责范围很广,通常由一名主任和副主任来领导(这些部门);但实际上,是由小型化的领导层负责,这种小马拉大车的方式,这本身就是挑战。因此,我们希望调整部门规模,使其大小得当。但更为重要的是,我们希望,将多个部门合并,更多地专注于相关的疾病。最好的例子是DGIEP(Division of Gastroenterology and Inborn Errors Products,胃肠病学与先天缺陷产品部门),这样的部门,仅仅是名称的罗列,没有多少实质意义。因此,我们现在将有一个新的罕见病与医学遗传学部门,这个部门将会纳入关注先天缺陷疾病的团队,而我们的罕见病小组,将会设立胃肠病和肝病部门。
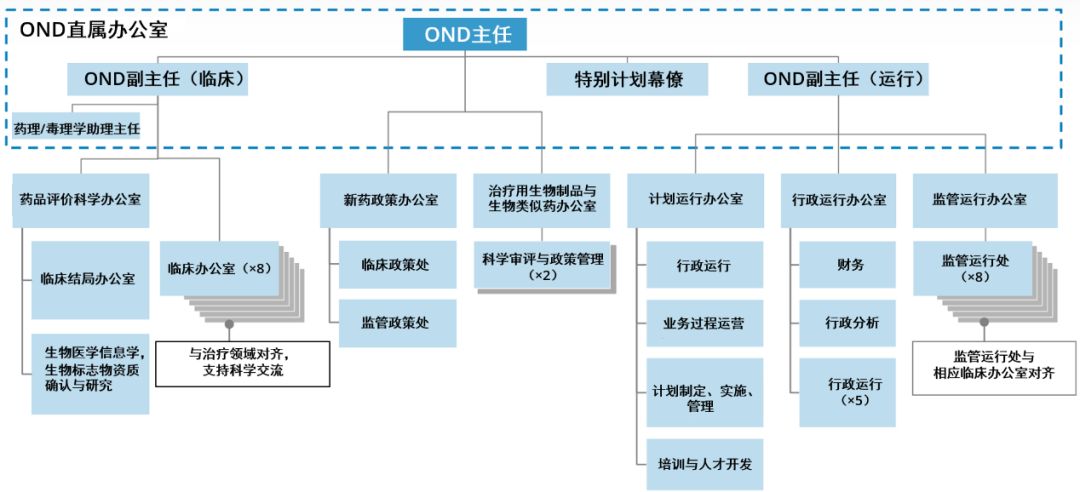
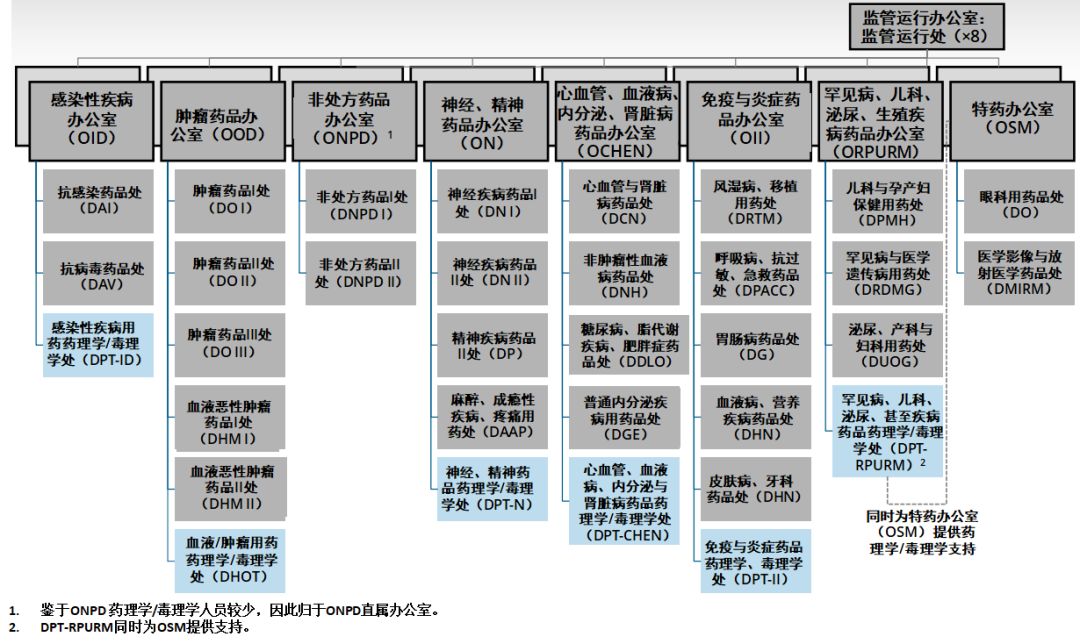
图片来源:参考资料[11],药明康德内容团队制图
对于大型部门,例如神经系统疾病药品部门,我们将其一分为二,使得领导层对监管工作量的分配更为合理,目的是使领导层能够更具战略性,更注重外部,能够领导并满足其治疗领域的广泛需求。不乏成功的例子,例如肿瘤学卓越中心(Oncology Center of Excellence,OCE)。
将多个办公室整合在一起的理念,能够在治疗领域上,更加统一。我们有炎症和免疫学办公室,实际上,涉及的所有相关药物,都可以跨部门。设立针对皮肤病、肺病和风湿病药物的办公室,同一办公室旗下的所有这三个部门,可以加强医学审评与管理计划管理人员之间的协作与互动。我希望通过这种方式,可以产生更多的对话,进一步促进药物开发,提高我们的技能,改进相关的药品监管。
所有办公室的药理学/毒理学部门,都将促进人员流动,因此在审评药品临床试验申请(IND)时,可以获得更为广泛的经验,加深理解,扩展视野。
现在还处于初期,但是我认为,增强协作和互动,将使我们能够更好地完成工作。我们将满怀希望,见证未来几年的发展。
免责声明:本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..